Кадгерин-катениновый комплекс в обучении и памяти - Cadherin–catenin complex in learning and memory
Долгосрочное потенцирование (LTP), который считается клеточной основой обучения и памяти, включает в себя определенный процесс передачи сигнала, который лежит в основе синаптической пластичности.[1]Среди многих механизмов, ответственных за поддержание синаптической пластичности, есть кадгерин –катенин сложный.[2]Образуя комплексы с внутриклеточными катенин белки, нейронные кадгерины (N-кадгерины ) служат связующим звеном между синаптической активностью и синаптическая пластичность, и играют важную роль в процессах обучения и памяти.
Считается, что N-кадгерины участвуют в обеспечении LTP и синаптических изменениях, лежащих в основе обучения и памяти. Во время эмбрионального развития кадгерины изначально широко распространены, но постепенно они становятся более локализованными в пре- и постсинаптических сайтах, в то время как синапсы формируются.[3] Блокирование функции кадгерина с помощью определенных белков не влияет на базальные синаптические свойства, но может нарушать индукцию LTP.[4]
Структурная функция и адгезия
Структура кадгерин-катенинового комплекса
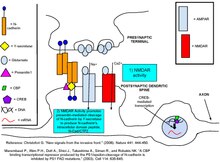
N-кадгерины - это трансмембранные белки, экспрессирующиеся в большинстве синапсов ЦНС.[5] N-кадгерины наиболее часто экспрессируются как в пресинаптической активной зоне, так и в областях постсинаптической плотности (PSD), и содержат как внеклеточные домены связывания Ca2 +, так и внутриклеточные домены для связывания своих белков-партнеров. Общим партнером по связыванию кадгеринов являются белки внутриклеточных катенинов, в частности, трех различных подтипов, α-катенинов, β-катенинов и катенинов семейства p120ctn. β-катенины и p120ctns связывают внутриклеточный домен кадгерина в дистальной и проксимальной областях соответственно.[6]α-катенины в мономерной форме будут связываться с комплексом кадгерин-катенин через β-катенины. В гомодимерной форме α-катенины не связывают β-катенины, но предпочтительно связывают F-актин и другие белки, способствующие полимеризации F-актина. .[7]Каждый подтип катенина и его взаимодействие с кадгеринами играет особую роль в обеспечении синаптической пластичности и структуры шипа.
Регулирование адгезии
Данные свидетельствуют о том, что N-кадгерины стабилизируют связь между пресинаптическим окончанием и постсинаптическим позвоночником. [8] и что это стабилизация увеличивает вероятность того, что высвобожденный глутамат будет связывать рецепторы постсинаптического нейрона.[9] На базовых уровнях синаптической активности N-кадгерины в основном являются мономерами и, следовательно, слабо адгезивны к кадгеринам, расположенным в клетке на противоположной стороне синапса. Приток Ca2 + через NMDAR способствует димеризации N-кадгеринов. Димеризованные кадгерины легко связываются со своими пресинаптическими кадгеринами-партнерами. Ингибирование связывания N-кадгерина посредством блокирующих антител предотвращает индукцию поздней фазы L-долгосрочной потенциации,[10] предполагая, что адгезионные свойства димерного N-кадгерина необходимы для поздней фазы L-LTP. Кроме того, деполяризация KCl пресинаптического аксона как придает протеазную устойчивость к N-кадгеринам, так и рассеивает их по всей PSD от их первоначальной кластеризации в синаптических точках,[11] тем самым повышая их эффективность в отношении клеточной адгезии.
Адгезия N-кадгерина дополнительно стабилизирует синапс, обеспечивая расширение головы позвоночника, вызванное активацией AMPAR.[12] Это морфологическое изменение помогает предотвратить дальнейшие синаптические модификации, которые могут поставить под угрозу информацию, содержащуюся в уже существующих синаптических связях. Расширение головы позвоночника достигает этого за счет уменьшения отношения NMDAR к AMPAR, создавая пропорционально меньший приток кальция, а также за счет более быстрой диффузии кальция из позвоночника. Быстрое удаление кальция не позволяет ему инициировать посттрансляционные модификации, которые в дальнейшем изменяли бы синаптическую силу.[13] Избыточная экспрессия мутанта N-кадгерина, неспособного к адгезии, предотвращает расширение головы позвоночника, демонстрируя важную роль N-кадгерина в этом процессе.[12]
Регулирование поверхностных уровней кадгерина, оборота и стабильности
Механизмы регуляции различаются потребностями в синтезе и временной инициацией.[8][14] Одним из способов регуляции кадгерина является стабилизация поверхности, довольно быстрый процесс (происходящий примерно через 100 минут после активности), который не зависит от синтеза белка.
Активность NMDAR снижает фосфорилирование β-катенина по tyr-654, тем самым ингибируя N-кадгерин. эндоцитоз и облегчение поверхностного удержания и выражения.[8][15]
Экспрессия на поверхности также регулируется через протоколадгерин -опосредованная адгезия. Протокадгерин-альфа и протокадгерин-гамма взаимодействуют с образованием белкового комплекса, который усиливает поверхностную экспрессию каждого подтипа кадгерина.[16]
Экспрессия кадгерина также регулируется интернализацией, вызванной активностью, которая происходит намного позже стабилизации поверхности (в среднем через 4 часа после стимула). Интернализация зависит от синтеза белка, и белки катенина p120 (p120ctn) участвуют в обмене, деградации и «кластеризации» кадгеринов в адгезивные соединения в синапсе.[17] Считается, что белки ctn P120 либо ингибируют эндоцитоз нейральных кадгеринов, либо действуют на поверхности клетки, чтобы контролировать оборот кадгерина.[17][18][19] Подавление p120 ctn приводит к большему эндоцитозу кадгерина и предотвращает адгезию между пре- и постсинаптическим нейроном.[18] Такие данные убедительно свидетельствуют о том, что p120 необходим для стабильности кадгерина.
Связывание и сигнализация
Партнеры внутриклеточного связывания
β-катенин локализует везикулы резервного пула (RPV) в пресинаптических участках.[20]Удаление β-катенина in vivo приводит к уменьшению количества RPV, локализованных в синаптическом сайте, и увеличению RPV, рассредоточенных вдоль аксона. Более того, RPV не реагировали на непрерывные серии стимуляции пресинаптического нейрона при нокауте B-катенина. Этот эффект B-катенина не зависит от адгезии, опосредованной кадгерином, и вместо этого модулируется белками, связывающими PDZ, такими как Veli, с кадгерином. Кроме того, BDNF /TrkB сигнализация приводит к фосфорилирование β-катенина на его сайте Y654, вызывая растворение комплекса β-катенин-кадгерин и, следовательно, увеличивая синаптический пузырек мобильность.[21]Катенины также связывают многие каркасные белки, рецепторы, киназы и фосфатазы. Напр., Комплекс кадгерин-α-катенин связывает актиновый цитоскелет, хотя неизвестно, связывается ли он посредством связывающих белков или прямых взаимодействий.[22]
Пути передачи сигнала

p120ctn сигнализирует через факторы обмена гуаниновых нуклеотидов (ГЭФ) и Пробелы активировать Семейство Rho GTPases. RhoA должен ингибироваться P120ctn для поддержания плотности и длины шипов. Rac (GTPase) ингибирование устраняет снижение плотности шипов при дефиците p120ctn.[23][24]Связывание E-кадгерина с p120ctn может активировать SRC, что приводит к активации Rac1, что приводит к фосфорилированию LIMK1 и LIMK2 для дезактивации кофилина, вызывающего полимеризацию G-актина. Между тем, фосфорилирование PI3K посредством SRC активирует RhoA, что приводит к активации кофилина-P и разрушению нитчатого актина.[25]Когда ген WAVE-1 был нарушен у мышей, это привело к когнитивным дефектам, таким как потери в обучении и памяти, связанные с ветвью WAVE-1 пути Rac.[26]Используя модель LTP зубчатой извилины in vivo, было показано, что индукция LTP связана с увеличением F-актин в дендритных шипах, и это долговременное изменение. Было показано, что для этого эффекта требуется активация рецептора NMDA. Кроме того, использование латрункулин A был способен нарушать LTP в поздней фазе в этой модели, что снова указывает на то, что ремоделирование актина необходимо для LTP.[27]
Клеточная функция
Роль в передаче / стабильности рецепторов
Когда белок, связывающий глутаматный рецептор, ABP и p120ctn коэкспрессируются, анти-p120ctn сыворотка вытягивает комплекс, содержащий оба белка, из клеточных лизатов. То же самое происходит с белком, похожим на ABP, который называется GRIP. Скрининг кДНК и спаривание дрожжей анализы продемонстрировать, что PDZ домен -связывающий мотив на С-конце p120ctn делает возможными такие взаимодействия. Co-IP Данные показывают, что p120ctn может одновременно образовывать комплекс с кадгерином и ABP или GRIP. Доминантно-отрицательные фрагменты p120ctn, которые не взаимодействовали с ABP и GRIP, нарушали стабилизацию GluR2 и GluR3 Субъединицы AMPAR соответственно на плазматическая мембрана. Совместная локализация p120ctn с PSD-95 предполагает, что комплексы кадгерин-p120ctn-ABP / GRIP закрепляют AMPAR в постсинаптическая плотность, но неясно, происходит ли закрепление также в перисинаптических сайтах.[28]
Регулирование экспрессии генов
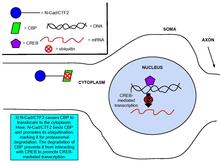
Было показано, что кадгерины и катенины участвуют в регуляции экспрессии генов, важном процессе синаптической пластичности.[8] Связывание глутамата с NMDA усиливает выработку пептида внутриклеточного домена N-кадгерина, N-cad / CTF2, эффект блокируется NMDA. антагонист рецепторов, APV. Трансфекция N-cad / CTF2 снижает ядерное CBP (CREB-связывающий белок ) и увеличивается цитозольный CBP. Кроме того, N-cad / CTF2 коиммунопреципитирует с CBP, и трансфекция N-cad / CTF2 снижает устойчивые уровни CBP, следовательно, нарушая CREB -содержащий ДНК сложное образование [29] (См. Рисунки справа).
Выражение лимфоидный энхансер-связывающий фактор 1 (LEF-1) запускает транслокацию β-катенина в ядро, где он активирует транскрипцию, а трансфекция N-кадгерина или α-катенина отменяет этот эффект.[30] Дополнительно лечение нейронов NMDAR агонист вызывает расщепление β-катенина N-конец, а C-терминал фрагменты перемещаются в ядро, где, как показывают эксперименты по трансфекции, β-катенин увеличивает транскрипцию, зависимую от Т-клеточного фактора (TCF).[31]
Рекомендации
- ^ Блаженство, TVP; Коллингридж Г.Л. (1993). «синаптическая модель памяти: долговременная потенциация в гиппокампе». Природа. 361 (6407): 31–39. Bibcode:1993Натура 361 ... 31Б. Дои:10.1038 / 361031a0. PMID 8421494.
- ^ Шрик, Кристина; Фишер, Андре; Srivastava, Deepak P .; Тронсон, Натали С .; Пензес, Питер; Радулович, Елена (сентябрь 2007 г.). «N-кадгерин регулирует цитоскелетно-ассоциированную передачу сигналов IQGAP1 / ERK и формирование памяти». Нейрон. 55 (5): 786–798. Дои:10.1016 / j.neuron.2007.07.034. ЧВК 2064867. PMID 17785185.
- ^ Бенсон, Дина Л .; Танака, Хидекадзу (1 сентября 1998 г.). «Перераспределение N-кадгерина во время синаптогенеза в нейронах гиппокампа». Журнал неврологии. 18 (17): 6892–6904. Дои:10.1523 / JNEUROSCI.18-17-06892.1998. PMID 9712659.
- ^ Тан, L; Повесил CP; Шурсан Э.М. (1998). «Роль кадгериновых молекул клеточной адгезии в долговременной потенциации гиппокампа». Нейрон. 17 (3): 423–434. Дои:10.1016 / S0896-6273 (00) 80175-0. PMID 8816706.
- ^ Яги, Т; Такеичи, М. (15 мая 2000 г.). «Гены суперсемейства кадгеринов: функции, геномная организация и неврологическое разнообразие». Гены и развитие. 14 (10): 1169–80. Дои:10.1101 / gad.14.10.1169. PMID 10817752.
- ^ Шарпио, L; Любовь, Дж; Колман, Д.Р. (2007). «Молекулы адгезии в нервной системе: структурное понимание функции и разнообразия». Анну. Преподобный Neurosci. 30: 451–474. Дои:10.1146 / annurev.neuro.29.051605.113034. PMID 17600523.
- ^ Ямада, S; Покутта, S; Drees, F; Вайс, Висконсин; Нельсон, WJ (2005). «Деконструкция комплекса кадгерин-катенин-актин». Клетка. 123 (5): 889–901. Дои:10.1016 / j.cell.2005.09.020. ЧВК 3368712. PMID 16325582.
- ^ а б c d Ариккат, Джьоти; Луи Ф. Райхардт (2008). «Кадгерины и катенины в синапсах: роли в синаптогенезе и синаптической пластичности». Тенденции Neurosci. 31 (9): 487–494. Дои:10.1016 / j.tins.2008.07.001. ЧВК 2623250. PMID 18684518.
- ^ Руди, Джерри (2008). Нейробиология обучения и памяти. Издатели Sinauer Associates, Inc. ISBN 978-0-87893-669-4.
- ^ Боздаго, О; Шан, Вт; Танака, Н; Benson, DL; Хантли, GW (2000). «Увеличение числа синаптических точек во время поздней фазы LTP: N-кадгерин синтезируется, рекрутируется в синаптические сайты и необходим для потенцирования». Нейрон. 28 (1): 245–259. Дои:10.1016 / S0896-6273 (00) 00100-8. PMID 11086998.
- ^ Танака, Н; Шан, Вт; Филлипс, GR; Арндт, К; Боздаги, О; Шапиро, Л; Хантли, GW; Benson, DL; Колман, Д.Р. (2000). «Молекулярная модификация N-кадгерина в ответ на синаптическую активность». Нейрон. 25 (1): 93–107. Дои:10.1016 / S0896-6273 (00) 80874-0. PMID 10707975.
- ^ а б Окамура, К. (2004). «Активность кадгерина необходима для индуцированного активностью ремоделирования позвоночника». J. Cell Biol. 167 (5): 961–972. Дои:10.1083 / jcb.200406030. ЧВК 2172468. PMID 15569714.
- ^ Хаяси, Й; Маевская, АК (2005). «Геометрия дендритного позвоночника: функциональное значение и регуляция». Нейрон. 46 (4): 529–532. Дои:10.1016 / j.neuron.2005.05.006. PMID 15944122.
- ^ Гумбинер, Б.М. (2000). «Регулирование адгезивной активности кадгерина». J. Cell Biol. 148 (3): 399–404. Дои:10.1083 / jcb.148.3.399. ЧВК 2174801. PMID 10662767.
- ^ Коской, Сильви; Gueudry, C .; Amblard, F .; Коской, С. (2008). «Эндоцитоз необходим для перераспределения E-кадгерина на стыках зрелых спаек». PNAS. 106 (17): 7010–15. Дои:10.1073 / pnas.0811253106. ЧВК 2678428. PMID 19372377.
- ^ Мурата, Й; Хамада, S; Моришита, H; Муто, Т; Яги, Т. (2004). «Взаимодействие с протокадгерином-гамма регулирует экспрессию протокадгерина-альфа на клеточной поверхности». J. Biol. Chem. 279 (47): 49508–16. Дои:10.1074 / jbc.M408771200. PMID 15347688.
- ^ а б Рейнольдс, Альберт Б .; Карнахан, Роберт Х. (декабрь 2004 г.). «Регулирование стабильности и оборота кадгерина с помощью p120ctn: последствия для болезней и рака». Семинары по клеточной биологии и биологии развития. 15 (6): 657–663. Дои:10.1016 / j.semcdb.2004.09.003. PMID 15561585.
- ^ а б Дэвис, Массачусетс; Ireton, RC; Рейнольдс, AB (2003). «Основная функция p120-катенина в обороте кадгерина». J. Cell Biol. 163 (3): 525–534. Дои:10.1083 / jcb.200307111. ЧВК 2173649. PMID 14610055.
- ^ Сяо, Каньян; Эллисон, Д. Ф.; Бакли, км; Коттке, доктор медицины; Винсент, Пенсильвания; Faundez, V; Ковальчик, А.П. (2003). «Клеточные уровни катенина p120 служат точкой отсчета для уровней экспрессии кадгерина в эндотелиальных клетках микрососудов». J. Cell Biol. 163 (3): 535–545. Дои:10.1083 / jcb.200306001. ЧВК 2173638. PMID 14610056.
- ^ Бамджи, Шерназ X .; Симадзу, Казухиро; Кимес, Николь; Huelsken, Joerg; Бирчмайер, Вальтер; Лу, Бай; Райхард, Луи Ф. (ноябрь 2003 г.). «Роль β-катенина в локализации синаптических пузырьков и пресинаптической сборке». Нейрон. 40 (4): 719–731. Дои:10.1016 / S0896-6273 (03) 00718-9. ЧВК 2757419. PMID 14622577.
- ^ Бамджи, Шерназ X .; Рико, Беатрис; Кимес, Николь; Райхард, Луи Ф. (17 июля 2006 г.). «BDNF мобилизует синаптические везикулы и усиливает формирование синапсов, нарушая взаимодействия кадгерин-β-катенин». Журнал клеточной биологии. 174 (2): 289–299. Дои:10.1083 / jcb.200601087. ЧВК 2064188. PMID 16831887.
- ^ Ариккат, Дж; Райхардт, LF (2008). «Кадгерины и катенины в синапсах». Тенденции Neurosci. 31 (9): 487–494. Дои:10.1016 / j.tins.2008.07.001. ЧВК 2623250. PMID 18684518.
- ^ Элиа, Лиза П .; Ямамото, Мия; Занг, Келинг; Райхард, Луи Ф. (июль 2006 г.). «Катенин p120 регулирует развитие дендритного позвоночника и синапсов через GTPases семейства Rho и кадгерины». Нейрон. 51 (1): 43–56. Дои:10.1016 / j.neuron.2006.05.018. ЧВК 2587166. PMID 16815331.
- ^ Окубо, Т; Одзава, М. (1999). «p120ctn связывается с проксимальной к мембране областью цитоплазматического домена E-кадгерина и участвует в модуляции адгезионной активности». J. Biol. Chem. 274 (30): 21409–21415. Дои:10.1074 / jbc.274.30.21409. PMID 10409703.
- ^ Тейлор, Мэтью П .; Koyuncu, Orkide O .; Энквист, Линн В. (27 апреля 2011 г.). «Подрыв актинового цитоскелета при вирусной инфекции». Обзоры природы Микробиология. 9 (6): 427–439. Дои:10.1038 / nrmicro2574. ЧВК 3229036. PMID 21522191.
- ^ Soderling, S. H .; Langeberg, L.K .; Содерлинг, Дж. А .; Davee, S.M .; Simerly, R .; Raber, J .; Скотт, Дж. Д. (10 февраля 2003 г.). «Потеря WAVE-1 вызывает сенсомоторную задержку и снижение обучаемости и памяти у мышей». Труды Национальной академии наук. 100 (4): 1723–1728. Bibcode:2003ПНАС..100.1723С. Дои:10.1073 / pnas.0438033100. ЧВК 149900. PMID 12578964.
- ^ Фукадзава, Юго; Сайто, Йошито; Одзава, Фумико; Охта, Ясухико; Мизуно, Кенсаку; Инокучи, Каору (май 2003 г.). «Гиппокампальный LTP сопровождается повышенным содержанием F-актина в дендритном отделе позвоночника, который необходим для позднего поддержания LTP in vivo». Нейрон. 38 (3): 447–460. Дои:10.1016 / S0896-6273 (03) 00206-X. PMID 12741991.
- ^ Silverman, J.B .; Restituito, S .; Ли-Эдвардс, Л .; Khatri, L .; Зифф, Э. (2007). «Синаптическое закрепление рецепторов AMPA кадгеринами посредством нейральных комплексов белка руки, связанного с плакофилином и рецептором AMPA». J. Neurosci. 27 (32): 8505–8516. Дои:10.1523 / JNEUROSCI.1395-07.2007. ЧВК 6672939. PMID 17687028.
- ^ Marambaud, P; Вэнь PH; Датт А; Shioi J; Такашима А .; Siman R; Робакис Н.К. (2003). «Связывающий CBP репрессор транскрипции, продуцируемый PS1 / эпсилон-расщеплением N-кадгерина, ингибируется мутациями PS1 FAD». Клетка. 114 (5): 635–645. Дои:10.1016 / j.cell.2003.08.008. PMID 13678586.
- ^ Симха, я; Штутман М; Salomon D; Журинский Ж; Садот Э; Гейгер Б; Бен-Зеев А (1998). «Дифференциальная ядерная транслокация и потенциал трансактивации β-катенина и плакоглобина». J. Cell Biol. 141 (6): 1433–1448. Дои:10.1083 / jcb.141.6.1433. ЧВК 2132796. PMID 9628899.
- ^ Абэ, К; Такеичи М (2007). «Активация рецептора NMDA вызывает опосредованное кальпаином расщепление β-катенина для запуска экспрессии гена». Нейрон. 53 (3): 387–397. Дои:10.1016 / j.neuron.2007.01.016. PMID 17270735.
