Горячий старт ПЦР - Hot start PCR - Wikipedia
Горячий старт ПЦР это модифицированная форма обычного полимеразной цепной реакции (ПЦР), которая уменьшает присутствие нежелательных продуктов и димеры праймеров из-за неспецифической амплификации ДНК при комнатной (или более низкой) температуре.[1][2] Поскольку результаты ПЦР настолько полезны, было разработано множество вариантов и модификаций процедуры для достижения более высоких выходов, ПЦР с горячим стартом является одной из них.[3] ПЦР с горячим стартом следует тем же принципам, что и обычная ПЦР - в ней используется ДНК-полимераза для синтеза ДНК из одноцепочечной матрицы,[4] тем не менее, он использует дополнительные методы нагрева и разделения, такие как инактивация или ингибирование связывания Полимераза Taq и позднее добавление полимеразы Taq для увеличения выхода продукта, а также для обеспечения более высокой специфичности и чувствительности.[5] Неспецифическое связывание и праймирование или образование димеров праймеров сводятся к минимуму путем завершения реакционной смеси после денатурация[6] Некоторые способы завершения реакционных смесей при высоких температурах включают модификации, которые блокируют ДНК-полимераза активность при низких температурах,[1][7] использование модифицированных дезоксирибонуклеотидтрифосфатов (дНТФ),[8] и физическое добавление одного из основных реагентов после денатурации.[9] Результаты этой процедуры имеют множество применений как в медицине, так и в промышленности. Например, применение ПЦР, включая судебно-медицинскую экспертизу, тестирование отцовства, биологическую защиту, клонирование, обнаружение мутаций, генетическое тестирование и секвенирование ДНК.[10]
Благодаря этим дополнительным методам ПЦР с горячим стартом может уменьшить количество неспецифических амплификаций, которые естественным образом возникают при более низких температурах, что остается проблемой для традиционной ПЦР. Эти модификации работают в целом, чтобы гарантировать, что определенные ферменты в растворе останутся неактивными или будут подавлены до тех пор, пока не будет достигнута оптимальная температура отжига.[10] Подавление образования неспецифических продуктов ПЦР, особенно на ранних циклах, приводит к значительному увеличению чувствительности обнаружения с помощью ПЦР. Это чрезвычайно важно для диагностических приложений ПЦР или ОТ-ПЦР.
Фон

Полимеразной цепной реакции (ПЦР) - это молекулярная биология метод, используемый для усиления определенных сегментов ДНК на несколько порядков. Конкретные сегменты ДНК амплифицируются в ходе трех процессов: денатурации, отжига и удлинения - при этом цепи ДНК разделяются путем повышения температуры до оптимальной от комнатной до того, как праймеры свяжутся и полимераза выровняет нуклеотиды с цепью матрицы. Оно использует ДНК-полимераза, который малоактивен при низких температурах.[1] В обычной ПЦР реакционная смесь завершается при комнатной температуре, и из-за активности ДНК-полимеразы могут образовываться праймеры. димеры праймеров или неспецифический отжиг с ДНК. Во время процедуры ПЦР ДНК-полимераза будет расширять любой фрагмент ДНК связанными праймерами, генерируя целевые продукты, но также и неспецифические продукты, которые снижают выход. В ПЦР с горячим стартом некоторые из реагенты хранятся отдельно, пока смесь не нагреется до определенной температуры отжига. Это сокращает время отжига, что, в свою очередь, снижает вероятность неспецифического удлинения ДНК и влияние неспецифического связывания праймера перед денатурацией.[6][5]
В традиционной ПЦР более низкие температуры ниже оптимальной температуры отжига (50-65 ° C) приводят к нецелевым модификациям, таким как неспецифические амплификации, при которых праймеры неспецифично связываются с нуклеиновой кислотой.[5] Эти неспецифические комплексы праймеров, которые присутствуют в избытке в смеси, являются причиной синтеза побочных продуктов, таких как димер праймера и неправильное праймирование.[10] Неправильное праймирование сильно затрудняет и снижает эффективность амплификации ПЦР из-за активной конкуренции с целевыми последовательностями за амплификацию. Точно так же димеры праймеров образуют комплексы, которые уменьшают количество полученных амплификаций числа копий.[10] Это можно контролировать с помощью ПЦР с горячим стартом, которая позволяет блокировать удлинения праймера до достижения оптимальных температур.[2]
В ПЦР с горячим стартом важные реагенты (такие как ДНК-полимераза и магний кофакторы ) предотвращаются от реакции в смеси для ПЦР до достижения оптимальных температур за счет физического разделения или химических модификаций.[5][2] ПЦР с горячим стартом также может происходить, когда полимераза Taq ингибируется / инактивирована или ее добавление откладывается до достижения оптимальных температур отжига, посредством модификаций дезоксирибонуклеотидтрифосфата или путем модификации праймеров посредством связывания и вторичная структура манипуляции.
ПЦР с горячим стартом часто является лучшим подходом по сравнению с традиционной ПЦР в обстоятельствах, когда в реакционной смеси отсутствует ДНК (> 104 копий), матрица ДНК очень сложна или если имеется несколько пар олигонуклеотид праймеры в ПЦР.[3]
Методы
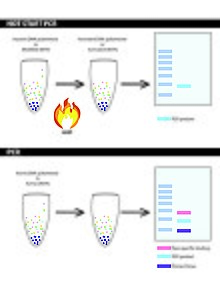
ПЦР с горячим стартом - это метод, который предотвращает удлинение ДНК-полимеразы при более низкой температуре, чтобы предотвратить неспецифическое связывание и минимизировать потерю урожая. ПЦР с горячим стартом снижает количество неспецифического связывания за счет ограничивающих реагентов до стадий нагревания ПЦР - ограничивает реакцию на ранней стадии, ограничивая ДНК-полимеразу Taq в реакции. Неспецифическое связывание часто приводит к образованию димеров праймеров и неправильно примированных / ложно примированных мишеней.[11] Их можно исправить с помощью модифицированных методов, таких как:
Инактивация / ингибирование ДНК-полимеразы Taq
Ферментно-связанные антитела / ДНК-полимераза Taq в комплексе с антителами к ДНК-полимеразе Taq:
Антитела, связанные с ферментом, инактивируют ДНК-полимеразу Taq. Антитела связываются и связываются с полимеразой, предотвращая раннюю амплификацию ДНК, которая может происходить при более низких температурах. Как только будет достигнута оптимальная температура отжига, антитела начнут разлагаться и диссоциировать, высвобождая ДНК-полимеразу Taq в реакцию и позволяя начать процесс амплификации.[2][12] ДНК-полимераза Platinum Taq и ДНК-полимераза AccuStart Taq (обе разработаны Ayoub Rashtchian из Life technologies и Quanta BioSciences, соответственно) являются примерами коммерчески доступных ДНК-полимераз Taq на основе антител с горячим запуском. Эти ДНК-полимеразы Taq предварительно соединены со смесью моноклональных антител, специфичных к ДНК-полимеразе Taq.[13]
Восковые бусины:
Физический барьер создается между ДНК-полимеразой Taq и остальными компонентами ПЦР восковыми шариками, которые зависят от температуры. Как только температура поднимается выше 70 ° C, во время стадии денатурации в первом цикле восковая гранула плавится, позволяя ДНК-полимеразе Taq выйти за барьер и высвободиться в реакцию - запуск процесса амплификации. Затем восковой слой перемещается к верхней части реакционной смеси во время стадии амплификации, чтобы позже действовать как пароизоляция.[2]
Высокоспецифичные олигонуклеотиды:
Олигонуклеотиды - это короткие полимеры нуклеиновой кислоты, которые легко связываются. Высокоспецифичные олигонуклеотиды, такие как аптамеры, связываются с ДНК-полимеразой Taq при более низких температурах, что делает ее неактивной в смеси. Только при более высоких температурах олигонуклеотиды отделяются от Taq, позволяя ему реагировать.[5]
Это наиболее эффективные методы ПЦР с горячим стартом, методы с использованием ферментно-связанных антител и высокоспецифичных олигонуклеотидов, в частности, наиболее подходят во время процедур, требующих более короткого времени инактивации.[14] Однако известны и другие методы, такие как:
Позднее добавление ДНК-полимеразы Taq
Предварительный нагрев:
Аппарат для ПЦР нагревают заранее, в то время как компоненты перемешивают на льду, а затем сразу же помещают в аппарат для ПЦР, когда он достигает оптимальной температуры. Это устранит необходимый процесс разогрева, уменьшит неспецифический отжиг праймеров и обеспечит разделение любых пропущенных пар праймеров в смеси.[15]
Замораживание:
Замораживание действует как форма физического разделения, как и восковые шарики. Реакционная смесь, содержащая праймеры, матричную цепь, воду и дезоксирибонуклеотидтрифосфат (dNTP), замораживается перед полимеразой Taq, а остальные компоненты ПЦР добавляются поверх замороженной смеси. Это предотвращает неспецифическое связывание.[15]
Позднее добавление Taq:
Компоненты ПЦР в реакционной смеси готовят и нагревают без добавления Taq. Taq вводится в смесь только после достижения оптимальной температуры. Однако этот метод наименее надежен и может привести к загрязнению компонентов.[15]
Другой метод - это опосредованная дезоксирибонуклеотидтрифосфатом ПЦР с горячим стартом, которая модифицирует нуклеотидные основания через защитную группу.
Модификации дезоксирибонуклеотидтрифосфата (dNTP)
Горячий старт dNTP может быть химически модифицирован для включения термочувствительной защитной группы на 3 основных концах. Эта модификация предотвратит взаимодействие нуклеотидов с полимеразой Taq для связывания с цепью матрицы до тех пор, пока после достижения оптимальных температур не будет достигнута оптимальная температура, поэтому защитная группа будет удалена на стадии тепловой активации. Горячие dNTP, dA, dT, dC и dG заменяют природные нуклеотиды.[16][17] Однако рекомендуется использовать все четыре модифицированных нуклеотида, предыдущие исследования показывают, что замены одного или двух природных нуклеотидов на модифицированные дНТФ будет достаточно для предотвращения неспецифической амплификации.[16][17] Другая химическая модификация нуклеиновой кислоты - это термообратимая ковалентная модификация, которая препятствует гибридизации праймеров с интересующей матрицей. Аминогруппа гуанозина взаимодействует с глиоксалем с образованием dG.[18]
Модифицированные праймеры
Вторичный состав:
Определенная вторичная структура может препятствовать работе праймеров. Например, олигонуклеотиды со структурой шпильки не могут эффективно действовать как праймер. Однако после нагревания реакционной смеси до температуры отжига праймер претерпит изменение конформации, позволяя праймеру вместо этого образовывать линейную структуру, что позволяет праймеру прикрепиться к целевому сегменту и начать ПЦР.[19][20]
Фотохимически снимаемые клетки:
Клеточная группа, которая является фотохимически удаляемой защитной группой, такая как заключенные в каркас тимидинфосфорамидиты, включена в олигонуклеотидный праймер. Это позволяет активировать и деактивировать функцию праймера с помощью УФ-излучения (365 нм). Следовательно, праймеры можно активировать после достижения температуры отжига.[21]
Контролируемое добавление магния
Магний необходим в ПЦР и действует как кофактор, поскольку полимераза Taq зависит от магния.[22] Повышение концентрации магния и фосфата до стандартных буферных реагентов создает магний осадок, обеспечивая «горячий старт» реакции, поскольку в ДНК-полимеразе нет магния до стадии термоциклирования. Во время термоциклирования магний снова растворяется в растворе и становится доступным для использования полимеразой, позволяя ей нормально функционировать.[23]
Преимущества
Преимущество ПЦР с горячим стартом состоит в том, что она требует меньшего обращения и снижает риск контаминации. ПЦР с горячим стартом может быть химически модифицирована или основана на антителах, что обеспечивает различные преимущества этой процедуры. В химически модифицированной ПЦР с горячим стартом процедуру можно проводить при комнатной температуре и она значительно снижает образование димеров праймеров, предотвращая связывание праймеров друг с другом до начала процесса ПЦР, а также ограничивая неспецифическое праймирование. Точно так же ПЦР с горячим стартом ингибирует связывание праймеров с матричными последовательностями, которые имеют низкую гомологию, что приводит к ошибочному запуску. Он также может улучшить специфичность и чувствительность из-за жестких условий, а также увеличить выход продукта целевого фрагмента.[5] В ПЦР с горячим стартом на основе антител полимераза активируется после начальной стадии денатурации во время цикла, что сокращает необходимое время. Это также приводит к высокому специфичность.[14]
Ограничения
Наряду со своими преимуществами, ПЦР с горячим стартом также имеет ограничения, которые необходимо учитывать перед применением метода. ПЦР с горячим стартом требует дополнительного нагрева в течение более длительных периодов времени, чем обычная ПЦР, поэтому матричная ДНК более подвержена повреждению. Увеличенное время нагревания также означает, что процедура несовместима с некоторыми процедурами, такими как метод обратной транскрипции-ПЦР с одной пробиркой и одним буфером, который требует более низкой температуры для прохождения стадии обратной транскрипции.[12] В химически модифицированной ПЦР с горячим стартом процесс амплификации ДНК может быть негативно затронут, во-первых, из-за значительного увеличения времени реактивации, необходимого для активации полимеразы, и, во-вторых, если длина целевой ДНК-матрицы слишком велика.[14] В процедурах на основе антител для каждого фермента требуются разные антитела, и поэтому стоимость выполнения процедуры выше.[15]
Рекомендации
- ^ а б c Шарки DJ, Scalice ER, Кристи KG, Этвуд SM, Daiss JL (май 1994). «Антитела как термолабильные переключатели: высокотемпературный запуск полимеразной цепной реакции». Био / Технологии. 12 (5): 506–9. Дои:10.1038 / nbt0594-506. PMID 7764710. S2CID 2885453.
- ^ а б c d е Пол Н, Шум Дж, Ле Т (2010). «Горячий старт ПЦР». Протоколы ОТ-ПЦР. Методы молекулярной биологии. 630. Humana Press. С. 301–18. Дои:10.1007/978-1-60761-629-0_19. ISBN 9781607616283. PMID 20301005.
- ^ а б Грин, Майкл Р .; Самбрук, Джозеф (май 2018 г.). «Горячий старт полимеразной цепной реакции (ПЦР)». Протоколы Колд-Спринг-Харбор. 2018 (5): pdb.prot095125. Дои:10.1101 / pdb.prot095125. ISSN 1940-3402. PMID 29717052.
- ^ Арьял, Сагар (2015-04-23). «Полимеразная цепная реакция (ПЦР) - принцип, процедура, типы, применение и анимация». Микробиология Info.com. Получено 2020-05-29.
- ^ а б c d е ж Берч Д.Е. (май 1996 г.). «Упрощенная ПЦР с горячим стартом». Природа. 381 (6581): 445–6. Bibcode:1996Натура.381..445Б. Дои:10.1038 / 381445a0. PMID 8632804. S2CID 4267296.
- ^ а б van Pelt-Verkuil E, van Belkum A, Hays JP, eds. (2008). «Варианты и адаптации стандартного протокола ПЦР». Принципы и технические аспекты амплификации ПЦР. Springer Нидерланды. С. 231–276. Дои:10.1007/978-1-4020-6241-4_12. ISBN 9781402062414.
- ^ «Чем полезна технология горячего старта для вашего ПЦР». Термофишер. Получено 2019-10-03.
- ^ "DNTP - Вики школы биомедицинских наук". training.ncl.ac.uk. Получено 2019-10-09.
- ^ Коулман ВБ (2016). Диагностическая молекулярная патология. [Лондон]: Elsevier Academic Press. ISBN 9780128011577. OCLC 960448665.
- ^ а б c d Лебедев, Александр В .; Пол, Наташа; Да, Джойклин; Тимощук Виктор А .; Шум, Джонатан; Мияги, Кей; Келлум, Джек; Hogrefe, Ричард I .; Зон, Джеральд (ноябрь 2008 г.). «Горячий старт ПЦР с активируемыми нагреванием праймерами: новый подход к повышению эффективности ПЦР». Исследования нуклеиновых кислот. 36 (20): e131. Дои:10.1093 / nar / gkn575. ISSN 1362-4962. ЧВК 2582603. PMID 18796527.
- ^ Кермекчиев, Милко Б .; Цеков Анатолий; Барнс, Уэйн М. (01.11.2003). «Чувствительные к холоду мутанты ДНК-полимеразы Taq обеспечивают горячий старт ПЦР». Исследования нуклеиновых кислот. 31 (21): 6139–6147. Дои:10.1093 / нар / gkg813. ISSN 0305-1048. ЧВК 275455. PMID 14576300.
- ^ а б Шенбруннер, Нэнси Дж; Гупта, Амар П.; Янг, Карен К. И .; Уилл, Стивен Дж (2017-01-01). «Ковалентная модификация праймеров улучшает специфичность и выход ПЦР-амплификации». Биологические методы и протоколы. 2 (1): bpx011. Дои:10.1093 / biomethods / bpx011. ISSN 2396-8923. ЧВК 6994073. PMID 32161793.
- ^ Westfall et.al. (1997), Focus 19.3, стр. 46.
- ^ а б c «Чем полезна технология горячего старта для вашего ПЦР - Австралия». www.thermofisher.com. Получено 2020-05-29.
- ^ а б c d "Что такое ПЦР с горячим стартом?". Генетическое образование. 2019-03-03. Получено 2020-05-29.
- ^ а б Кухарева, Инна; Лебедев, Александр (15.06.2009). «3'-Защищенные 2'-дезоксинуклеозид-5'-трифосфаты как инструмент для инициируемой нагреванием активации полимеразной цепной реакции». Аналитическая химия. 81 (12): 4955–4962. Дои:10.1021 / ac8026977. ISSN 0003-2700. ЧВК 2712722. PMID 19438248.
- ^ а б Кухарева, И .; Haoqiang, H .; Yee, J .; Shum, J .; Paul, N .; Hogrefe, R. I .; Лебедев, А.В. (01.09.2008). "Активируемые нагреванием 3'-модифицированные дНТФ: синтез и применение для ПЦР с горячим стартом". Серия симпозиумов по нуклеиновым кислотам. 52 (1): 259–260. Дои:10.1093 / nass / nrn131. ISSN 0261-3166. PMID 18776352.
- ^ [1], «Обратимая химическая модификация нуклеиновых кислот и улучшенный метод гибридизации нуклеиновых кислот», выпущенный 2002-10-03
- ^ Айленберг, М. и Сильверман, М., 2000-11-1, Контролируемый горячий старт и улучшенная специфичность при проведении ПЦР с использованием праймеров с ретушью и петлей (TULIPS), Biotechniques, 29 (5): 1018-1022, DOI: 10.2144 / 00295st03, PMID: 11084864
- ^ Кабоев, О.К .; Лучкина, Л. А .; Третьяков, А. Н .; Бахрманд, А. Р. (2000-11-01). «Горячий старт ПЦР с использованием праймеров со структурой молекулярных маяков (структура шпильки)». Исследования нуклеиновых кислот. 28 (21): e94. Дои:10.1093 / nar / 28.21.e94. ISSN 0305-1048. ЧВК 113163. PMID 11058144.
- ^ Янг, Дуглас Д .; Эдвардс, Уэсли Ф .; Lusic, Hrvoje; Живо, Марк О .; Дейтерс, Александр (10.01.2008). «Полимеразная цепная реакция, запускаемая светом». Химические коммуникации (4): 462–464. Дои:10.1039 / B715152G. ISSN 1364-548X. ЧВК 3760149. PMID 18188468.
- ^ Markoulatos, P .; Siafakas, N .; Монкань, М. (2002). «Мультиплексная полимеразная цепная реакция: практический подход». Журнал клинического лабораторного анализа. 16 (1): 47–51. Дои:10.1002 / jcla.2058. ISSN 0887-8013. ЧВК 6808141. PMID 11835531.
- ^ Барнс, Уэйн М; Роулик, Кэтрин Р. (июнь 2002 г.). «Метод горячего старта осаждения магния для ПЦР». Молекулярные и клеточные зонды. 16 (3): 167–171. Дои:10.1006 / mcpr.2002.0407. PMID 12219733.
