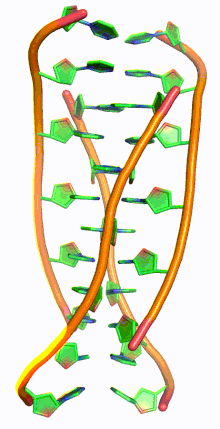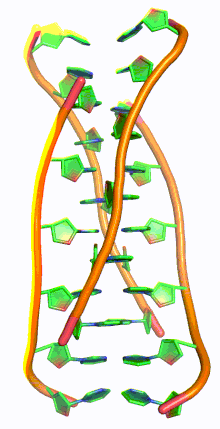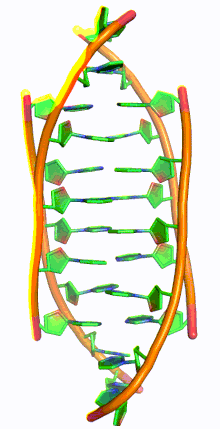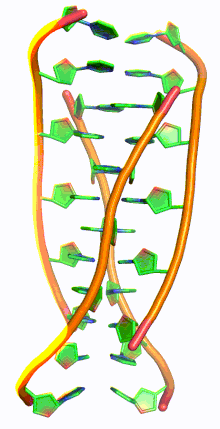
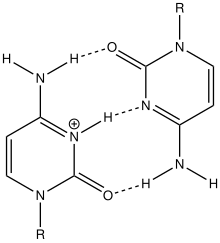
I-мотив ДНК - I-motif DNA
i-мотив ДНК, также называемый я-ДНК, является разновидностью необычной структуры дезоксирибонуклеиновая кислота, впервые обнаруженный в 1993 г. Морис Герон и коллеги в École Polytechnique, Франция,[1] а затем обнаружил в ядра клеток в 2018 году. Аббревиатура вставной мотив, четырехниточный i-мотив не похож на культовый двойная спираль ДНК.[2] I-мотивы представляют собой четырехцепочечные квадруплексные структуры, образованные цитозин -богатая ДНК, похожая на G-квадруплекс структуры, которые образуют богатую гуанином ДНК. С-богатые участки ДНК распространены в частях генома, регулирующих гены.[3] Недавно в клетках человека были обнаружены i-мотивы, и было показано, что они играют роль в воспроизводстве клеток.[4] I-мотивы имеют потенциальное применение в нанотехнологии и наномедицина, потому что размер больше 1 нм и меньше 100 нм из-за их уникальных pH чувствительность и использовались как биосенсоры, наномашины, и молекулярные переключатели.[3]
История
ДНК i-мотива была впервые обнаружена в 1993 году Морисом Героном и его коллегами из Политехнической школы во Франции.[1] но до 2018 года были только свидетелями in vitro, а не в живых клетках.[5] Последнее открытие, объявленное в 2018 году, относилось к Институт медицинских исследований Гарвана и Университет Нового Южного Уэльса и финансируется Национальный совет здравоохранения и медицинских исследований и Австралийский исследовательский совет. Соруководителями исследовательской группы были профессор Дэниел Крист и профессор Марсель Динджер.[2]
Открытие
Доктор Махди Зераати из Института Гарвана говорит, что i-мотив был обнаружен благодаря его появлению и исчезновению внутри клетки и отличительным связям через цитозины, а не через буквы пар оснований. Исследовательская группа разработала новый точный инструмент для поиска i-мотива - фрагмента молекулы антитела - который может специфически распознавать и прикрепляться к i-мотивам «с очень высоким сродством».[2]
Структура
G-квадруплексные структуры ДНК существуют в богатых G районах ДНК. Комплементарная цепь ДНК, богатая цитозином, также может образовывать четырехцепочечную квадруплексную структуру, называемую i-мотивом. Пары оснований цитозина в структуре i-мотива образуют вставленный и антипараллельный тетрамер структура.[8] Эта структура формируется не-Ватсон-Криковской парой оснований C · C+ взаимодействие цитозин пар оснований.[8] C · C+ соединение - это разновидность Спаривание оснований Хугстина и на самом деле имеет более сильные взаимодействия пар оснований и энергию спаривания оснований, чем традиционные Спаривание оснований Watson Crick G · C: 169,7 кДж / моль для C · C+ спаривание оснований и 96,6 кДж / моль для спаривания оснований G · C.[8] C · C+ облигация имеет три водородные связи: два между водородом аминов и атомами кислорода с двойной связью противоположного цитозина, и один между азотом и водородом, связанным с N+.[9] Эти пары оснований сшивают две петли ДНК.[9] Учитывая полу-протонированный характер атомов азота в цитозине, участвующих в C · C+ связывания, эта пара оснований традиционно наиболее стабильна в диапазоне pH = 5–6, что значительно ниже физиологического pH (7,3).[10] Однако недавняя работа обнаружила доказательства наличия структур i-мотива при pH, близком к нейтральному, при комнатной температуре.[11] Райт и др. обнаружил, что количество цитозинов в последовательности определяет, может ли последовательность, богатая C, образовывать структуру i-мотива при физиологическом pH, как и отрицательная суперсильность[12] и молекулярное скопление.[11][13] При комнатной температуре нуклеотидные тракты должны иметь длину не менее 5 цитозинов, чтобы складываться в i-мотивы при pH, близком к нейтральному; дополнительные цитозины увеличивают термостабильность.[11][14] Кроме того, внутримолекулярные цепи i-мотива являются наиболее стабильными, когда в цепи ДНК имеется не менее 6 последовательных цитозиновых оснований, в то время как менее 6 последовательных цитозинов в цепи благоприятствуют межмолекулярным C · C+ пары.[10] Эта pH-зависимость структуры i-мотива считается критической для ее активности in vivo и функции в клетке, поскольку предполагается, что pH является механизмом контроля, используемым для образования и разрушения i-мотива.[14]
Биологическая функция
Постулируется, что I-мотивы играют роль в регуляции и экспрессии генов в клетке.[15] Большие участки ДНК, богатой G / C, существуют вблизи сайтов начала транскрипции в геноме и присутствуют в большом количестве геномов организма, что позволяет предположить, что участки, богатые C, имеют биологическую функцию.[16] Кроме того, многие белки и лиганды, лежащие в основе экспрессии генов, распознают олигонуклеотиды с высоким содержанием C, такие как поли-C-связывающий белок (PCBP ) и гетерогенный ядерный рибонуклеопротеин К (ГНРПК ).[16] До недавнего времени не было ясно, существуют ли I-мотивы в ДНК в природе из-за их низкой стабильности при физиологическом pH;[16] i-мотивы были обнаружены in vivo в ДНК человека в 2018 году.[17] Теломерная ДНК человека (hTelo) может образовывать вторичную структуру i-мотива in vitro.[18] Zeraati et al. подтвердили присутствие i-мотива hTelo в ДНК человека с помощью флуоресцентного маркера iMab.[17] Кроме того, i-мотив hTelo был обнаружен в регулирующие регионы генома в конце Фаза G1 из цикл воспроизводства клеток, что указывает на участие i-мотивов в продвижение гена и регулирование.[17] I-мотивы также могут действовать как молекулярные каркасы, помогая в фактор транскрипции связывание во время транскрипция гена помогая промоутерам, таким как BCL2 в прикреплении к правильной последовательности ДНК.[17][19] Повышенная экспрессия i-мотива не совпадала с увеличением G-квадруплекс выражение, которое вместо этого увеличивается во время S фаза.[17] Это указывает на то, что G-квадруплекс и i-мотивы не являются комплементарными структурами, несмотря на их комплементарные последовательности, а вместо этого являются взаимоисключающими и выполняют противоположные роли в регуляции экспрессии генов.[17]
Приложения
I-мотивы особенно полезны из-за их уникальной чувствительности к изменениям кислотности, близким к физиологическому pH. Исследование в Боннский университет использовали сворачивание I-мотива для сжатия и ослабления кольца ДНК. Было синтезировано кольцевое кольцо ДНК с определенными участками ДНК, богатыми углеродом.[20] При pH 5 эти области сокращались, образуя i-мотивы, сжимая кольцо так же, как закрытие мешка для мусора. При pH 8 области I-мотива схлопывались обратно в свои линейные формы, расслабляя кольцо. Кольца ДНК, которые могут сжиматься и ослабляться в зависимости от pH, могут использоваться для построения более сложных структур взаимосвязанной ДНК, например катенаны и ротаксаны.[20] Эти структуры ДНК могут функционировать как молекулярные переключатели. Другое исследование показало, что однослойные углеродные нанотрубки (SWNT), обычно используемые для переноса лекарств в организме, индуцируют образование I-мотива в теломерной ДНК человека.[21] Исследует модифицированную теломерную ДНК человека, богатую углеродом, путем присоединения окислительно-восстановительной группы метиленового синего к 3'-концу и электрода к 5'-концу. В конформации I-мотива эта модифицированная цепь ДНК дает большое увеличение Фарадеевское течение. Этот биосенсор реагирует только на SWNT, что позволяет исследователям обнаруживать определенный тип углеродных нанотрубок с пределом прямого обнаружения 0,2 ppm.[21]
Смотрите также
Рекомендации
- ^ а б Геринг, Калле; Лерой, Жан-Луи; Герон, Морис. «Тетрамерная структура ДНК с протонированными парами оснований цитозин-цитозин». Природа. 363: 561–565. Дои:10.1038 / 363561a0.
- ^ а б c Публичное заявление: «Обнаружена новая форма ДНК в наших клетках».
- ^ а б c Benabou, S .; Aviñó, A .; Eritja, R .; González, C .; Гаргалло, Р. (2014). «Фундаментальные аспекты структур i-мотива нуклеиновой кислоты» (PDF). RSC Adv. 4 (51): 26956–26980. Дои:10.1039 / c4ra02129k. ISSN 2046-2069.
- ^ Зераати, Махди; Лэнгли, Дэвид Б.; Шофилд, Питер; Moye, Aaron L .; Руэ, Ромен; Хьюз, Уильям Э .; Брайан, Трейси М .; Динджер, Марсель Э .; Христос, Даниил (23 апреля 2018 г.). «I-мотивные структуры ДНК образуются в ядрах клеток человека». Химия природы. 10 (6): 631–637. Дои:10.1038 / s41557-018-0046-3. ISSN 1755-4330. PMID 29686376.
- ^ «Ученые подтвердили новую структуру ДНК внутри человеческих клеток», статья Питера Докрилла, 23 апреля 2018 г. [1]
- ^ Snoussi, K .; Nonin-Lecomte, S .; Леру, J.L. (30 мая 2001 г.). «РНК И-МОТИФ». Дои:10.2210 / pdb1i9k / pdb. Цитировать журнал требует
| журнал =(помощь) - ^ Гурунг, Сара П .; Шварц, Кристина; Холл, Джеймс П .; Кардин, Кристин Дж .; Brazier, Джон А. (2015). «Важность длины петли для стабильности структур i-мотива». Химические коммуникации. 51 (26): 5630–5632. Дои:10.1039 / c4cc07279k. ISSN 1359-7345. ЧВК 4384421. PMID 25686374.
- ^ а б c Benabou, S .; Aviñó, A .; Eritja, R .; González, C .; Гаргалло, Р. (2014). «Фундаментальные аспекты структур i-мотива нуклеиновой кислоты» (PDF). RSC Adv. 4 (51): 26956–26980. Дои:10.1039 / c4ra02129k. ISSN 2046-2069.
- ^ а б Чжан, Си Юань; Ло, Хун Цюнь; Ли, Нянь Бинг (15 июня 2014 г.). «Кристаллический фиолетовый как зонд со структурой i-мотива для обратимого и не содержащего метки электрохимического переключателя pH». Аналитическая биохимия. 455: 55–59. Дои:10.1016 / j.ab.2014.03.015. ISSN 0003-2697. PMID 24699211.
- ^ а б Ли, Тао; Фамулок, Майкл (22 января 2013 г.). «Функционализация наноциклов ДНК, запрограммированная I-мотивами». Журнал Американского химического общества. 135 (4): 1593–1599. Дои:10.1021 / ja3118224. ISSN 0002-7863. PMID 23312021.
- ^ а б c Райт, Элиза П .; Huppert, Julian L .; Уоллер, Зои А. Э. (9 февраля 2017 г.). «Идентификация множественных последовательностей геномной ДНК, которые образуют структуры i-мотива при нейтральном pH». Исследования нуклеиновых кислот. 45 (6): 2951–2959. Дои:10.1093 / nar / gkx090. ISSN 0305-1048. ЧВК 5605235. PMID 28180276.
- ^ Солнце, Дээкю; Херли, Лоуренс Х. (14 мая 2009 г.). «Важность отрицательной суперсильности в индукции образования структур G-квадруплекса и i-мотива в промоторе c-Myc: значение для нацеливания на лекарства и контроля экспрессии генов». Журнал медицинской химии. 52 (9): 2863–2874. Дои:10.1021 / jm900055s. ISSN 0022-2623. ЧВК 2757002. PMID 19385599.
- ^ Цуй, Цзинцзин; Уолтман, Филипп; Ле, Ву; Льюис, Эдвин (15 октября 2013 г.). «Влияние молекулярного краудинга на стабильность I-мотива последовательности промотора c-MYC человека при нейтральном pH». Молекулы. 18 (10): 12751–12767. Дои:10.3390 / молекулы 181012751. ISSN 1420-3049. ЧВК 6270392. PMID 24132198.
- ^ а б Зераати, Махди; Лэнгли, Дэвид Б.; Шофилд, Питер; Moye, Aaron L .; Руэ, Ромен; Хьюз, Уильям Э .; Брайан, Трейси М .; Динджер, Марсель Э .; Христос, Даниил (23 апреля 2018 г.). «I-мотивные структуры ДНК образуются в ядрах клеток человека». Химия природы. 10 (6): 631–637. Дои:10.1038 / s41557-018-0046-3. ISSN 1755-4330. PMID 29686376.
- ^ Райт, Элиза П .; Huppert, Julian L .; Уоллер, Зои А. Э. (9 февраля 2017 г.). «Идентификация множественных последовательностей геномной ДНК, которые образуют структуры i-мотива при нейтральном pH». Исследования нуклеиновых кислот. 45 (6): 2951–2959. Дои:10.1093 / nar / gkx090. ISSN 0305-1048. ЧВК 5605235. PMID 28180276.
- ^ а б c Benabou, S .; Aviñó, A .; Eritja, R .; González, C .; Гаргалло, Р. (2014). «Фундаментальные аспекты структур i-мотива нуклеиновой кислоты» (PDF). RSC Adv. 4 (51): 26956–26980. Дои:10.1039 / c4ra02129k. ISSN 2046-2069.
- ^ а б c d е ж Зераати, Махди; Лэнгли, Дэвид Б.; Шофилд, Питер; Moye, Aaron L .; Руэ, Ромен; Хьюз, Уильям Э .; Брайан, Трейси М .; Динджер, Марсель Э .; Христос, Даниил (23 апреля 2018 г.). «I-мотивные структуры ДНК образуются в ядрах клеток человека». Химия природы. 10 (6): 631–637. Дои:10.1038 / s41557-018-0046-3. ISSN 1755-4330. PMID 29686376.
- ^ Manzini, G .; Yathindra, N .; Ходо, Л. Э. (11 ноября 1994 г.). «Доказательства внутримолекулярно свернутых структур i-ДНК в биологически значимых последовательностях CCC-повторов». Исследования нуклеиновых кислот. 22 (22): 4634–4640. Дои:10.1093 / nar / 22.22.4634. ISSN 0305-1048. ЧВК 308511. PMID 7984411.
- ^ Кан, Хён-Джин; Кендрик, Саманта; Hecht, Sidney M .; Херли, Лоуренс Х. (7 марта 2014 г.). «Транскрипционный комплекс между i-Motif BCL2 и hnRNP LL представляет собой молекулярный переключатель для контроля экспрессии генов, которая может модулироваться небольшими молекулами». Журнал Американского химического общества. 136 (11): 4172–4185. Дои:10.1021 / ja4109352. ISSN 0002-7863. ЧВК 3985447. PMID 24559432.
- ^ а б Ли, Тао; Фамулок, Майкл (22 января 2013 г.). «Функционализация наноциклов ДНК, запрограммированная I-мотивами». Журнал Американского химического общества. 135 (4): 1593–1599. Дои:10.1021 / ja3118224. ISSN 0002-7863. PMID 23312021.
- ^ а б Пэн, Инхуа; Ван, Сяохуэй; Сяо, И; Фэн, Линъянь; Чжао, Чао; Рен, Джинсонг; Цюй Сяоган (30 сентября 2009 г.). «Квадруплексный биосенсор на основе ДНК i-Motif для различения одно- и многослойных углеродных нанотрубок». Журнал Американского химического общества. 131 (38): 13813–13818. Дои:10.1021 / ja9051763. ISSN 0002-7863. PMID 19736925.