Mansonella perstans - Mansonella perstans - Wikipedia
| Mansonella perstans | |
|---|---|
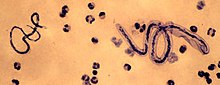 | |
| М. perstans (слева) и Лоа лоа (верно) | |
| Научная классификация | |
| Королевство: | |
| Тип: | |
| Учебный класс: | |
| Заказ: | |
| Семья: | |
| Род: | Mansonella |
| Разновидность: | Mansonella perstans (Мэнсон, 1891) |
| Синонимы | |
Acanthocheilonema perstans | |
Mansonella perstans это трансмиссивный человек филяриальный нематода, передается крошечным кровососущим мухи называется мошки.[1] Mansonella perstans одна из двух филяриальных нематод, вызывающих серозную полость филяриоз в людях. Другая филяриальная нематода - это Мансонелла озарди. М. perstans широко распространен во многих частях К югу от Сахары, части Центральная и Южная Америка, а Карибский бассейн.[1][2]
По сравнению с инфекциями, вызываемыми другими нитчатыми паразитами, такими как Wuchereria Bancrofti, Brugia malayi, и Лоа лоа, Mansonella инфекции относительно легкие. Однако патогенность М. perstans инфекция недавно была пересмотрена в различных исследованиях.[3] Эти исследования показали, что М. perstans обладает способностью вызывать различные клинические признаки, в том числе ангионевротический отек Калабароподобные вздутия, зуд, высокая температура, Головная боль, эозинофилия, и боль в животе. Общая инвалидность среди населения в регионах с филяриями эндемичный было трудно определить из-за высоких показателей коинфекция с другими филяриями и неспецифичностью М. перстан инфекции. Кроме того, лечение М. perstans сложно, потому что большинство антифилярных препаратов, таких как ивермектин, диэтилкарбамазин, и альбендазол не эффективны. Оптимальное лечение М. perstans инфекция остается неясной.[3] Большинство современных исследований сосредоточено на коинфекции М. perstans с другими филяриями паразиты, и изучение Вольбахия бактерии как эндосимбионты в М. perstans и другие нитчатые паразиты.
История открытия
В 1890 г. микрофилярии из М. perstans были впервые обнаружены Мэнсоном в крови пациента из Западная Африка кто был госпитализирован с сонная болезнь в Лондон. Поскольку микрофилярии впервые были отмечены у пациента с Африканский трипаносомоз, М. perstans изначально предполагалось, что это причина этого заболевания. М. perstans поскольку причина африканского трипаносомиоза была позже исключена Комиссией Королевского общества по сонной болезни, которая показала, что географическое распространение сонной болезни не совпадает с географическим распределением сонной болезни. М. perstans инфекционное заболевание.
После их открытия микрофилярии были названы Filaria sanguinis hominis minorиз-за их относительно небольшого размера по сравнению с микрофиларами другого типа, обнаруженными у того же пациента (Filaria sanguinis hominis major, который теперь известен как Лоа лоа ). Позже название было изменено на Filaria sanguinis hominis perstans, а позже снова сокращено до Филария перстанс соблюдать двоичная система номенклатуры. Со временем название продолжало меняться по мере изменения родового статуса паразита. В 1984 году Эберхард и Орихель изменили определение род Mansonella и включены М. perstans видов в нем, поэтому в настоящее время он известен как М. perstans.
Взрослые черви М. perstans были впервые восстановлены во время вскрытие обследование двух коренных индейцев в Британская Гвиана из их брыжейки и субперикардиального жира. Пока насекомое вектор была выдвинута гипотеза, потребовалось много лет исследований, прежде чем истинный вектор М. perstans был открыт.[4]
Клинические проявления у людей
Пока Mansonella инфекции часто протекают бессимптомно, они могут быть связаны с ангионевротическим отеком (аналогично Калабарские отеки лоисиса), рецидивирующий подкожный зуд поражения, жар, головные боли, артралгия, и неврологические проявления.[5] Также могут присутствовать эозинофилия, головная боль, лихорадка или боль в животе. М. perstans может также иметь состояние, известное как Кампала, или угандийский глазной червь.[6] Это происходит, когда взрослые черви М. perstans вторгнуться в конъюнктива или периорбитальный соединительной ткани в глаза. Это состояние было впервые приписано М. perstans в Уганда, когда у шести пациентов появились узелки в конъюнктива.[6] Взрослые черви были идентифицированы как взрослые самки. М. perstans в пяти из этих шести случаев. Симптомы М. perstans может быть перепутан с инфекциями других филяриозных инфекций, таких как онхоцеркоз, лимфатический филяриоз и лоаз, потому что часто возникает коинфекция.[7]
Пример использования
36-летний мужчина был госпитализирован в поликлинику миссионерской больницы Гунди на юге г. Чад в мае 2001 г. Он жаловался на нарушение зрения на левый глаз, глаз и брюшную полость. зуд и боли в животе. Ранее он лечился с помощью DEC от М. perstans инфекция за пять месяцев до его посещения. Образец крови был взят в 11:00 и исследован под микроскопом в виде плотного мазка крови, окрашенного Решение Гимзы. Толстый мазок крови показал наличие М. perstans, а других паразитов обнаружено не было. У него было 3% эозинофилия. Тест на остроту зрения показал снижение остроты зрения до 4/10 для левого глаза, а для правого глаза - 9/10. Однако при осмотре передней камеры левого глаза никаких отклонений не наблюдалось. При осмотре дна его левого глаза было обнаружено узкое, белое, неподвижное и линейное поражение размером 6-7 мм. Затем ему был проведен второй курс DEC (400 мг в день двумя дозами в течение восьми дней после трехдневного увеличения дозы), и к концу лечения у него не было зуда, но его нарушение зрения не изменилось. В М. perstans нагрузка была значительно снижена, а количество периферического эозинохпила снизилось до 1%. Затем его лечили мебендазолом (100 мг два раза в день в течение 14 дней), и по окончании лечения его нарушение зрения было единственным оставшимся симптомом. Через неделю без дальнейшего лечения его зрение улучшилось, а острота зрения на левый глаз увеличилась до 8/10. В то время как глазные симптомы возникают довольно часто при симптоматическом М. perstans инфекции, внутриглазная локализация не была описана до этого исследования. Этот случай также является примером сложности лечения мансонеллеза и показывает, что комбинированные лекарственные препараты могут быть более эффективными, чем лечение с использованием одного лекарственного средства.[8]
Другая важная клиническая информация
М. perstans потенциально могут вмешиваться в регуляторные механизмы хозяина и влиять на исход других инфекций, таких как малярия, туберкулез и ВИЧ, которые часто процветают в аналогичных условиях.
Недавние исследования также были сосредоточены на коинфекции М. perstans и другие нитчатые паразиты. Исследование эпидемиологии Лоа лоа, Onchocerca volvulus, и М. perstans в деревнях тропического леса Камерун обнаружили высокую распространенность коинфекции с О. voluvulus и М. perstans.[7] Он также обнаружил низкую распространенность L. loa и О. voluvulus коинфекция, а также низкая распространенность L. loa и М. perstans коинфекция.[7] Коинфекция также имеет серьезные последствия для лечения, поскольку эффективные лекарства от М. perstans отличаются от таковых для большинства филяриатных инфекций.
В другом исследовании оценивалась эффективность ивермектина и альбендазола при М. perstans и Wuchereria Bancrofti коинфекция в эндемичном регионе филярий Мали, обнаружив, что М. perstans инфекция не оказала существенного влияния на лечение W. Bancrofti.[9] В других исследованиях оценивалась эффективность других методов лечения коинфекции другими филяриатными паразитами и М. perstans.[9]
Передача инфекции
М. perstans передается при укусе видов Куликоидес мошки. Только самки мошек питаются кровью, потому что кровь нужна для созревания яиц внутри самки.
Резервуар
Люди - единственный известный резервуар для М. perstans. Нет животных резервуары за М. perstans происходят, как есть для Mansonella streptocerca.
Вектор
Различные виды Куликоидес их можно найти по всему миру, а в некоторых областях их большое количество делает их неприятными укусами для людей и домашних животных. Куликоидес виды - это толстые мухи с короткими вертикальными хоботками и крыльями, сложенными ножницами над брюшком в состоянии покоя. Обычно они имеют длину 1–4 мм. Крылья большинства видов имеют узор из светлых и темных отметин. Хотя некоторые виды Куликоидес, Такие как C. austeni и C. grahamii была выдвинута гипотеза, что они играют большую роль, чем другие виды, в передаче М. perstans, очень немногие исследования пытались определить виды переносчиков М. perstans в эндемичных районах. Этот вопрос еще более усложняется, поскольку таксономия тропических Куликоидес вид все еще не определен.
Кусающие мошки переходят от яйца к личинка, куколка, и, наконец, взрослая стадия. Полный цикл длится 2–6 недель и зависит от условий окружающей среды. Самки обычно кусаются на рассвете и в сумерках, хотя часто и в другое время. Яйца откладываются через 3–4 дня после еды кровью, и каждый раз откладывается около 70–180 яиц. Влага важна для переносчика и развития его яиц и личинок. Взрослые особи выживают в течение нескольких недель, а дальность их полета ограничена несколькими сотнями метров от мест обитания личинок.[1]
Морфология
Взрослые особи белые, нитевидные и имеют цилиндрическую форму. Самцы имеют длину 35–56 мм и 45–60 мм. мкм широкий.[2][5] Самки крупнее, 70–80 мм в длину и 80–120 мкм в ширину.[5] Хвост состоит из половины спирали у самок и полной спирали у самцов. Взрослые черви встречаются редко, но иногда их можно восстановить после лапаротомии или вскрытия.[10]
Микрофилярии М. perstans без оболочки, имеют тупой хвост, а их ядра доходят до конца хвоста. Микрофилярии имеют длину 200 мкм и ширину 4,5 мкм. Они могут удлиняться и сжиматься, поэтому могут различаться по размеру и форме. Они меньше, чем у Лоа лоа, которые имеют конические хвосты и часто скручены. Микрофилярии М. perstans меньше, чем у W. Bancrofti каудальный конец тупой с терминальным ядром.
Жизненный цикл
Во время кровопролития инфицированная мошка (Culicoides grahami и C. austeni) вводит филяриальных личинок третьей стадии (L3) на кожу человека-хозяина, где они проникают в рану от укуса. Тепло тела, вероятно, активирует личинок и побуждает их покинуть переносчик и активно проникнуть через кожу.
Личинки третьей стадии развиваются во взрослых особей, которые живут в полостях тела, чаще всего в плевральной и брюшной полостях. Также они могут жить в брыжейке, околопочечных пространствах, забрюшинное пространство, или перикард и взрослеют.
Взрослые особи спариваются в полостях тела и производят незащищенные субпериодические микрофилярии, которые достигают кровотока. Микрофилярии также можно найти в спинномозговая жидкость. Хотя периодичность появления этих мошек неясна, последнее исследование предполагает, что микрофилярии указывают на слабую, но значительную суточную периодичность с пиком около 8 часов утра.[11]
Мыша заглатывает микрофилярии во время еды кровью. После проглатывания микрофилярии мигрируют из средней кишки мошки через гемоцель к грудным мышцам мошки. В грудных мышцах микрофилярии развиваются в личинок второй стадии. Впоследствии они развиваются в личинок третьей стадии, которые заразны.
Личинки третьей стадии мигрируют в мошонку. хоботок, где они могут заразить другого человека, когда мошка съест кровь.[5]
Диагностические тесты
Подобно другим нитчатым паразитам, М. perstans диагностируется путем выявления микрофилярий в периферической крови. Поскольку микрофилярии присутствуют в периферической крови в почти равных концентрациях днем и ночью, образцы крови можно получить в любое время (в отличие от других филярийных микрофилярий). Микрофилярии короткие и тонкие, без оболочки, с закругленными хвостами с ядрами на конце. Головное пятно иногда имеет V-образный вид. Образец крови может быть толстым мазком, окрашенным Гимза или же гематоксилин и эозин.[5] Для повышения чувствительности можно использовать методы концентрации. К ним относятся центрифугирование пробы крови лизируется на 2% формалин (Метод Нотта) или фильтрация через мембрану Nucleopore®.[5] Серология не очень полезна для диагностики. Поскольку взрослые черви живут в основном в плевральный и брюшные полости, они наблюдаются редко. Иногда их можно наблюдать во время лапаротомия. М. perstans часто возникает при других филяриозных инфекциях, таких как онхоцеркоз и лимфатический филяриоз. Его следует отличать от Микрофилярия полукруглая (паразит животных, который иногда вызывает случайные инфекции у людей[10]). Иногда возможна путаница, если мазок крови случайно инфицирован во время или после подготовки плесенью, например Helicospora. Однако этот организм значительно меньше и тоньше микрофилярии. Было показано, что тест DEC или Mazzotti оказывает незначительное влияние на интенсивность микрофилярий, но не имеет практического применения для диагностики мансонеллеза.
Ведение и лечение
М. perstans - одна из наиболее трудно поддающихся лечению филярийных инфекций человека. Эффективное лечение мансонеллеза отсутствует, и среди научного сообщества нет единого мнения относительно оптимального подхода.[12] Многочисленные испытания традиционных антифилярных препаратов, таких как ивермектин и ДЭК, а также других бензимидазолов, таких как мебендазол, альбендазол, левамизол, и тиабендазол, были проведены. Недавно прошли клинические испытания по оценке эффективности доксициклин лечить М. perstans инфекции также были задокументированы.
Как правило, DEC неэффективен при лечении М. perstans инфекционное заболевание.[12] Другие препараты, такие как ивермектин и празиквантел были опробованы, но не являются ни надежными, ни быстро эффективными. Мебендазол и тиабендазол имеют больший эффект, чем ранее описанные препараты, но их недостаточно для лечения. Комбинированное лечение ДЭК и мебендазолом имело наибольший успех.[12] В самом последнем клинические испытания Доксициклин имеет успех, сравнимый, если не лучший, с успехом комбинированного лечения. Однако, поскольку это относительно недавнее открытие, использование доксициклина относительно ограничено клиническими испытаниями. Если у пациента нет симптомов, лечение не требуется. Ниже приведен анализ результатов различных клинических испытаний каждого препарата:
Диэтилкарбамазин
Пока диэтилкарбамазин (DEC) - наиболее распространенный препарат для лечения М. perstans инфекции, он часто оказывается неэффективным, особенно при приеме однократной дозы. В исследовании 2005 г. с участием 160 пациентов с симптоматическим М. perstans инфекции на юге Чада, DEC вводили в дозе 200 мг. дозы два раза в день в течение 21 дня с постепенным увеличением дозировки в первые три дня. [3] Однократный курс DEC снизил микрофиларии у 80% пациентов, но не устранил инфекцию или связанные с ней симптомы.[3] Поэтому был проведен второй курс, который в большинстве случаев помог устранить микрофилярную нагрузку.[3] Нет стойкого эффекта DEC на Микрофилярия был отмечен при долгосрочном наблюдении.[3] Эти результаты точно отражают общую эффективность ДЭК в лечении М. perstans: две дозы необходимы для временного устранения микрофилярной нагрузки, но стойкий эффект ДЭК на микрофилярии не наблюдался. Кроме того, DEC обычно не снимает полностью симптомы. Не сообщалось о возникновении побочных эффектов у пациентов с М. perstans инфекционное заболевание.
Ивермектин
Пока ивермектин считается средством первой линии для лечения многих филяриозных заболеваний (особенно онхоцеркоз ), он не показал никакой эффективности против М. perstans в дозе 200 мкг / кг массы тела или в дозе 600 мкг / кг массы тела.[3] В исследовании 2009 г., проведенном в Уганде, оценивалось влияние ивермектина, альбендазола и комбинированного режима приема обоих препаратов на М. perstans инфицированные: однократные дозы ивермектина не оказали заметного воздействия на М. perstans микрофиларемия в течение 12 месяцев после лечения, при этом количество подсчетов остается до значений до лечения. Это согласуется с результатами предыдущих исследований, которые показали, что ивермектин, когда он используется отдельно, оказывает незначительное влияние на М. perstans микрофиларемии. Отмечено снижение микрофилярий у пациентов, но для достижения этого требуется много времени (более 3 лет приема ивермектина), и, таким образом, в краткосрочной перспективе оно бесполезно для пациентов с симптомами.[3]
Альбендазол
Разовые дозы альбендазол постоянно сообщалось, что они оказывают незначительное влияние на М. perstans микрофиларемии через 6 и 12 м после лечения, при этом количество микрофиляреий остается близким к значениям до лечения.[13] Более поздние исследования показали, что препарат более эффективен в высоких дозах в течение продолжительных периодов времени. В недавних исследованиях не сообщалось о побочных эффектах.[3][13]
Мебендазол
Мебендазол, другое возможное лечение М. perstans филяриатоз, как было показано, эффективно снижает уровень микрофилярий. Он оказался более эффективным, чем ивермектин, и DEC - с большим количеством респондеров, более значительным снижением уровня микрофилярий и способностью более эффективно устранять инфекцию.
Тиабендазол
Тиабендазол было показано, что приводит к небольшому, но значительному снижению микрофилярий и эозинофил считать, и симптомы как лечение симптоматического М. perstans инфекционное заболевание.[14] Эти маркеры были снижены еще больше после введения второй дозы, показывая, что тиабендазол может быть эффективным при М. perstans инфекционное заболевание.[14] В недавнем сравнительном исследовании тиабендазол продемонстрировал более высокую активность, чем отдельные лекарственные препараты, такие как ивермектин, ДЭК и мебендазол, но более низкую активность, чем комбинированный режим мебендазола и ДЭК.[3] Однако могут потребоваться дополнительные исследования для подтверждения правильной дозировки и истинной эффективности тиабендазола в борьбе с М. perstans инфекционное заболевание.
Празиквантел
Празиквантел эффективен против различных глистный и простейшие инфекции. Несколько исследований об использовании празиквантела против М. perstans инфекции не поддерживают его использование для лечения мансонеллеза.[3][15]
Доксициклин
Доксициклин было показано, что снижает развитие, эмбриогенез, и плодовитость червей у видов, которые несут внутриклеточный эндосимбионт Вольбахия. Wolbachiae - бактериальные эндосимбионты насекомых и многих филяриальных нематод, таких как Onchocerca volvulus, Wuchereria bancrofti, и Brugia malayi.[16] Зависимость этих паразитов от их эндосимбионтов привела к использованию антибиотиков, направленных против вольбахий, антибиотиков, которые, как было продемонстрировано, оказывают глубокое благотворное влияние на филяриозные инфекции.[17] В 2009 году Кулибали и др. провела открытое рандомизированное исследование доксициклина, антибиотика, для Mansonella perstans инфекционное заболевание.[18] Это привело к резкому и устойчивому снижению уровней микрофилярий: они снизились до 23% от уровней до обработки через 6 м после обработки и до 0% от уровней до обработки через 12 м после обработки. Кроме того, доксициклин обладает макрофилярицидной активностью, что является уникальным среди препаратов от филяриатоза.[18]
Однако в некоторых регионах, таких как Габон и Уганда, Вольбахия эндосимбионтов не обнаружено в микрофиляриях М. perstans.[9] Это предполагает наличие некоторых географических обособлений М. perstans возможно, потеряли (или приобрели) эндосимбионт.[9] Это является спорным аргументом в пользу использования доксициклина для лечения филяриатных инфекций.[19] С одной стороны, доксициклин оказался одним из немногих эффективных средств лечения М. perstans, и может облегчить искоренение нитчатых паразитов. Однако некоторые ученые утверждают, что лечение филяриатоза доксициклином может привести к выделению глистов, которые уже интегрировались. Вольбахия гены в их геном, что потенциально может иметь непредвиденные последствия. Такой латеральный перенос генов происходил в различных географических изолятах Б. малайский, в котором доля Вольбахия Геном эндосибмионта интегрирован в хромосому его хозяина-нематоды (паразита). Когда эта интеграция происходит, Вольбахия больше не могут использоваться как средство лечения филяриатоза.[19]
Комбинированные схемы
Было показано, что комбинированное лечение, состоящее из ДЭК плюс мебендезол или ивермектина и альбендазола, приводит к очень значительному снижению микрофилярий.[3][13] Другие исследования поставили под сомнение эти результаты, предполагая, что комбинированное лечение ивермектином и альбендазолом не приводит к значительному снижению уровня микрофилярий в большей степени, чем при однократной схеме лечения.[13]
Эпидемиология
М. perstans Встречается в тропической Африке, центральной и восточной части Южной Америки, Центральной Америке и Карибском бассейне. Паразит широко распространен во многих частях Африки к югу от Сахары. Инфекции зарегистрированы из 33 стран этого региона.[1] В некоторых местах очень большая часть жителей проявляет признаки инфекции. Часто встречается среди бедных слоев населения, проживающих в сельской местности. М. perstans также встречается в Америке в Венесуэла, Тринидад, Гайана, Суринам, северный Аргентина и Бассейн Амазонки. Этот паразит не встречается в Азии.[10] Также не встречается в самых северных и южных регионах Африки. Недавний обзор М. perstans в Африке заявляет, что сегодня в Африке этим паразитом инфицировано около 114 миллионов человек.[20]
Стратегии общественного здравоохранения и профилактики
В осуществляемых в настоящее время крупномасштабных программах борьбы с онхоцеркозом и лимфатическим филяриозом мансонеллиозу уделяется мало внимания. Несмотря на высокую распространенность М. perstans в районах тропической Африки, таких как Уганда, Конго, Республика Камерун, и Габон, никаких векторных программ для каких-либо паразитов, вызывающих мансонеллез, не создано. Основные причины отсутствия внимания заключаются в том, что М. perstans инфекции преобладают среди бедных сельских жителей, и заражение паразитом не связано с четкой и отчетливой медицинской картиной. Большая часть информации о М. perstans был получен как побочный продукт при исследованиях других нитчатых паразитов.[1] Таким образом, мансонеллиоз можно классифицировать как один из самых запущенных среди запущенных. тропические болезни.[1] Куликоидес мошки достаточно малы, чтобы пройти через скрининг или противомоскитные сетки, так что они не помогут. Защита посетителей эндемичных территорий может быть достигнута за счет использования репелленты от насекомых.
Смотрите также
Рекомендации
- ^ а б c d е ж Simonsen PE, Onapa AW, Asio SM (сентябрь 2011 г.). «Филяриатоз Mansonella perstans в Африке». Acta Tropica. 120 Приложение 1: S109-20. Дои:10.1016 / j.actatropica.2010.01.014. PMID 20152790.
- ^ а б «Мансонеллиоз - перстанс». ГИДЕОН: Глобальная сеть инфекционных заболеваний и эпидемиологии. 2010.
- ^ а б c d е ж грамм час я j k л Брегани Э.Р., Ровеллини А., Мбайдум Н., Магнини М.Г. (май 2006 г.). «Сравнение различных схем лечения антигельминтных препаратов против Mansonella perstans filariasis». Труды Королевского общества тропической медицины и гигиены. 100 (5): 458–63. Дои:10.1016 / j.trstmh.2005.07.009. PMID 16257021.
- ^ Мэнсон П. (1891). "The Filaria sanguinis hominis major и незначительный, два новых вида гематозоа". Ланцет. 137 (3514): 4–8. Дои:10.1016 / с0140-6736 (02) 15666-2.
- ^ а б c d е ж ЦКЗ «Филяриатоз. Жизненный цикл Mansonella perstans" (2009).
- ^ а б Duong TH, Kombila M, Ferrer A, Nguiri C, Richard-Lenoble D (1998). «Снижение микрофиларемии Mansonella perstans после лечения альбендазолом». Труды Королевского общества тропической медицины и гигиены. 92 (4): 459. Дои:10.1016 / s0035-9203 (98) 91093-8. PMID 9850409.
- ^ а б c жВанджи С., Тендонгфор Н., Эсум М., Ндинденг С., Эньонг П. (февраль 2003 г.). «Эпидемиология сопутствующих инфекций, вызванных Loa loa, Mansonella perstans и Onchocerca volvulus в деревнях тропических лесов Камеруна». Медицинская микробиология и иммунология. 192 (1): 15–21. Дои:10.1007 / s00430-002-0154-x. PMID 12592559. S2CID 42438020.
- ^ Брегани Э. Р., Керальди Т., Ровеллини А., Гирингелли С. (2002). «История болезни: внутриглазная локализация Mansonella perstans у пациента из южного Чада». Труды Королевского общества тропической медицины и гигиены. 96 (6): 654. Дои:10.1016 / s0035-9203 (02) 90343-3. PMID 12625144.
- ^ а б c d Кейзер ПБ, Кулибали Ю.И., Кейта Ф., Траоре Д., Диалло А, Диалло Д.А. и др. (Сентябрь 2003 г.). «Клинические характеристики реакций после лечения на ивермектин / альбендазол для Wuchereria bancrofti в регионе, эндемичном по Mansonella perstans». Американский журнал тропической медицины и гигиены. 69 (3): 331–5. Дои:10.4269 / ajtmh.2003.69.331. PMID 14628953.
- ^ а б c "Mansonella perstans". Конспект лекций по дистанционному обучению. Архивировано из оригинал на 2009-06-14. Получено 2010-02-26.>
- ^ Asio SM, Simonsen PE, Onapa AW (март 2009 г.). «Анализ 24-часовой микрофилярной периодичности Mansonella perstans». Паразитологические исследования. 104 (4): 945–8. Дои:10.1007 / s00436-008-1312-х. PMID 19107522. S2CID 10415739.
- ^ а б c Брегани Э. Р., Тантардини Ф, Ровеллини А. (июнь 2007 г.). «[Mansonella perstans filariasis]». Параситология. 49 (1–2): 23–6. PMID 18416002.
- ^ а б c d Asio SM, Simonsen PE, Onapa AW (январь 2009 г.). «Mansonella perstans: безопасность и эффективность одного ивермектина, одного альбендазола и двух препаратов в комбинации». Анналы тропической медицины и паразитологии. 103 (1): 31–7. Дои:10,1179 / 136485909x384929. PMID 19173774. S2CID 7956333.
- ^ а б Брегани Э. Р., Ровеллини А., Тарсия П. (2003). «Влияние тиабендазола на Mansonella perstans филяриатоз ». Параситология. 45 (3–4): 151–153. PMID 15267104.
- ^ Дэвис А. (1996). «Лечение шистосомоза - празиквантел». В Cook GC (ред.). Тропические болезни Мэнсона (двадцатое изд.). Лондон: Saunders Co. Ltd., стр. 1444.
- ^ Тейлор MJ, Банди C, Hoerauf A (2005). «Бактериальные эндосимбионты Wolbachia филяриатных нематод». Достижения в паразитологии. 60: 245–84. Дои:10.1016 / S0065-308X (05) 60004-8. ISBN 9780120317608. PMID 16230105.
- ^ Кейзер ПБ, Кулибали Ю., Кубофчик Дж., Диалло А.А., Клион А.Д., Траоре С.Ф., Натман ТБ (август 2008 г.). «Молекулярная идентификация Wolbachia от филяриальной нематоды Mansonella perstans». Молекулярная и биохимическая паразитология. 160 (2): 123–8. Дои:10.1016 / j.molbiopara.2008.04.012. ЧВК 2497444. PMID 18538871.
- ^ а б Кулибали Ю.И., Дембеле Б., Диалло А.А., Липнер Э.М., Думбия С.С., Кулибали С.Ю. и др. (Октябрь 2009 г.). «Рандомизированное испытание доксициклина при инфекции Mansonella perstans». Медицинский журнал Новой Англии. 361 (15): 1448–58. Дои:10.1056 / nejmoa0900863. ЧВК 3410935. PMID 19812401.
- ^ а б Рауль Д. (январь 2010 г.). «Доксициклин при инфекции Mansonella perstans». Медицинский журнал Новой Англии. 362 (3): 272, ответ автора 272–3. Дои:10.1056 / NEJMc0910675. PMID 20089982.
- ^ Mourembou G, Fenollar F, Lekana-Douki JB, Ndjoyi Mbiguino A, Maghendji Nzondo S, Matsiegui PB, et al. (2015-10-20). «Mansonella, включая потенциальные новые виды, как общие паразиты у детей в Габоне». PLOS забытые тропические болезни. 9 (10): e0004155. Дои:10.1371 / journal.pntd.0004155. ЧВК 4618925. PMID 26484866.
дальнейшее чтение
внешняя ссылка
- «Филяриатоз». DPDx - Лабораторная идентификация паразитов, вызывающих озабоченность в области общественного здравоохранения. Центры США по контролю и профилактике заболеваний. Архивировано из оригинал 15 января 2009 г.
- "Mansonella perstans". Нематоды и забытая геномика. Архивировано из оригинал 17 мая 2003 г.
- Mansonella в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

