Зауратеграст - Zaurategrast
 | |
| Клинические данные | |
|---|---|
| Другие имена | CDP323 |
| Легальное положение | |
| Легальное положение |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.158.922 |
| Химические и физические данные | |
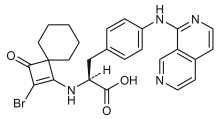
| Формула | C26ЧАС25BrN4О3 |
| Молярная масса | 521.415 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Зауратеграст (CDP323) представляет собой небольшую молекулу пролекарство антагонист из молекула адгезии сосудистых клеток 1 (VCAM-1) связывание с α4-интегрины. Первоначально он был разработан Британский биофармацевтическая компания Celltech plc. (сейчас же UCB S.A. ) и был предполагаемый новый препарат для устный лечение рассеянный склероз.[1]
В октябре 2006 г. UCB и Биоген Идек объявила о сотрудничестве по совместной разработке и коммерциализации зауратеграста для лечения рассеянный склероз и другой потенциал показания.[2] В июне 2009 года разработка зауратеграста была прекращена из-за неутешительных результатов Фазы II. клиническое испытание.[3]
Механизм действия
В механизм действия зауратеграста полагались на предотвращение иммунные клетки мигрировать из кровеносный сосуд через стенки сосуда, чтобы добраться до различных воспаленный ткани, в том числе мозг. Считается, что этот механизм предотвращает чрезмерное усиление иммунных реакций и последующее повреждение тканей, которое наблюдается во время неконтролируемой миграции иммунных клеток, как при рассеянном склерозе. Зауратеграст имеет тот же механизм действия, что и моноклональное антитело натализумаб.
Результаты на животных моделях
Зауратеграст исследовали в хроническом экспериментальный аутоиммунный энцефаломиелит (EAE) в мышей. Препарат был эффективен при введении профилактически (т.е. до болезнь был индуцирован у мышей) и при введении терапевтически (т.е. после вспышки заболевания) и значительно снизили тяжесть заболевания.[4]
Клиническая разработка
Безопасность, переносимость, и фармакокинетический профиль зауратеграста был оценен на 75 здоровых добровольцах женского и мужского пола в трех отдельных исследованиях фазы 1. Зауратеграст хорошо переносился при пероральном приеме до 1000 мг дважды в день в течение 7 дней. последовательный дней с неблагоприятное событие профиль сравним с тем, что наблюдается с плацебо. Гендерного эффекта не было. Пероральный прием привел к торможение связывания VCAM-1, которое может поддерживаться в течение 12- или 24-часового интервала приема при хорошо переносимых дозах[5]
Фаза 2 исследования началась в июне 2007 г. Европа и в НАС. В исследование намерены включить более 200 пациентов с рецидивирующим РС, которые ранее не прошли лечение интерферон-бета и сравнит две дозы препарата с плацебо в течение шести месяцев. Результаты ожидаются к концу 2008 года.,[6][7] Предварительный промежуточный анализ эффективности показал, что пациенты, включенные в это клиническое испытание, не получили ожидаемого улучшения от зауратграста по сравнению с плацебо после шестимесячного периода лечения. Случаев прогрессирующей мультифокальной лейкоэнцефалопатии не было.[3]
Рекомендации
- ^ Давенпорт Р.Дж., Мандей-младший (июль 2007 г.). «Антагонизм альфа4-интегрина - эффективный подход к лечению воспалительных заболеваний?». Открытие наркотиков сегодня. 12 (13–14): 569–76. Дои:10.1016 / j.drudis.2007.05.001. PMID 17631252.
- ^ Пресс-релиз UCB S.A. 2 октября 2006 г .; доступ 11 сентября 2007 г.
- ^ а б UCB: прекращение исследований по CDP323.
- ^ Watt G, Gauden V, McNeil K et al. Эффект CDP323, низкомолекулярного антагониста VLA-4, на хронический экспериментальный аллергический энцефаломиелит у мышей C57Bl / 6. ECTRIMS 2005; доступ 11 сентября 2007 г.
- ^ Бейкер М., Шок А, Партон Т. и др. Фармакокинетические и фармакодинамические свойства ингибитора VLA-4 CDP323. ECTRIMS 2006; доступ 11 сентября 2007 г.
- ^ Пресс-релиз UCB S.A. 26 июня 2007 г .; доступ 11 сентября 2007 г.
- ^ Clinicaltrial.gov Запись; доступ 11 сентября 2007 г.
