Компартментные модели в эпидемиологии - Compartmental models in epidemiology
Было предложено, чтобы эта статья была слился с Математическое моделирование инфекционного заболевания. (Обсуждать) Предлагается с сентября 2020 года. |
Компартментные модели упростить математическое моделирование инфекционных заболеваний. Население назначается отсекам с метками - например, S, я, или же р, (Sвосприимчивый, яинфекционный, или ризвлечен). Люди могут перемещаться между отсеками. Порядок наклеек обычно показывает схемы потока между отсеками; например, SEIS означает "восприимчивый", "незащищенный", "заразный", затем снова "восприимчивый".
Происхождение таких моделей - начало 20 века, при этом важная работа Кермак и МакКендрик в 1927 году.[1]
Модели чаще всего работают с обыкновенными дифференциальными уравнениями (которые являются детерминированными), но также могут использоваться со стохастической (случайной) структурой, которая более реалистична, но гораздо сложнее для анализа.
Модели пытаются предсказать такие вещи, как распространение болезни, общее число инфицированных или продолжительность эпидемии, а также оценить различные эпидемиологические параметры, такие как репродуктивное число. Такие модели могут показать, насколько разные меры общественного здравоохранения может повлиять на исход эпидемии, например, какой метод является наиболее эффективным для выпуска ограниченного количества вакцина в данной популяции.
Модель SIR
В Модель SIR[2][3][4] является одной из простейших компартментных моделей, и многие модели являются производными от этой базовой формы. Модель состоит из трех отделений:
- S: Количество sвосприимчивые люди. Когда восприимчивый и заразный индивидуум входят в «инфекционный контакт», восприимчивый индивидуум заражается болезнью и переходит в инфекционный компартмент.
- я: Количество яинфекционные лица. Это инфицированные лица, способные заразить восприимчивых людей.
- р для количества рэмоции (и иммунитет) или умершие люди. Это люди, которые были инфицированы и либо вылечились от болезни и попали в удаленный отсек, либо умерли. Предполагается, что количество смертей незначительно по отношению к общей численности населения. Этот отсек также можно назвать "ризвлечено "или"рesistant ".
Эта модель достаточно предсказуема[5] для инфекционных заболеваний, которые передаются от человека к человеку, и когда выздоровление обеспечивает длительную сопротивляемость, например корь, свинка и краснуха.

Эти переменные (S, я, и р) представляют количество людей в каждом отсеке в определенное время. Чтобы представить, что количество восприимчивых, заразных и удаленных людей может меняться со временем (даже если общая численность популяции остается постоянной), мы делаем точное количество функцией т (время): S(т), я(т) и р(т). Для конкретного заболевания в конкретной популяции эти функции могут быть разработаны для прогнозирования возможных вспышек и их контроля.[5]
Как следует из переменной функции т, модель динамична в том смысле, что числа в каждом отделении могут меняться со временем. Важность этого динамического аспекта наиболее очевидна в эндемичный заболевание с коротким инфекционным периодом, например корь в Великобритании до введения вакцина в 1968 г. Такие заболевания, как правило, возникают в циклах вспышек из-за различий в количестве восприимчивых (S (т)) через некоторое время. Во время эпидемия число восприимчивых людей быстро падает, поскольку все больше из них заражаются и, таким образом, попадают в инфекционные и удаленные компартменты. Болезнь не может повториться, пока не восстановится количество уязвимых, например в результате рождения потомства в восприимчивом компартменте.

Каждый член популяции обычно прогрессирует от восприимчивого к инфекционному до выздоровевшего. Это можно представить в виде блок-схемы, на которой прямоугольники представляют различные отсеки, а стрелки - переходы между отсеками, т.е.
Скорость перехода
Для полной спецификации модели стрелками должны быть указаны скорости перехода между отсеками. Между S и я, скорость перехода предполагается равной d (S / N) / dt = -βSI / N2, куда N - общая популяция, β - среднее количество контактов на человека за раз, умноженное на вероятность передачи болезни при контакте между восприимчивым и заразным субъектом, и SI / N2 - это доля контактов между инфицированным и восприимчивым человеком, которые привели к инфицированию восприимчивого человека. (Это математически похоже на закон массового действия в химии, в которой случайные столкновения между молекулами приводят к химической реакции, а относительная скорость пропорциональна концентрации двух реагентов).
Между я и р, предполагается, что скорость перехода пропорциональна количеству инфекционных особей, которое составляет γя. Это равносильно предположению, что вероятность выздоровления заразного человека в любой интервал времени dt просто γdt. Если человек заразен в течение среднего периода времени D, то γ = 1 /D. Это также эквивалентно предположению о том, что продолжительность времени, проведенного человеком в инфекционном состоянии, является случайной величиной с экспоненциальное распределение. «Классическая» модель SIR может быть модифицирована путем использования более сложных и реалистичных распределений для скорости перехода I-R (например, Распределение Erlang[6]).
Для особого случая, когда нет удаления из инфекционного отсека (γ = 0), модель SIR сводится к очень простой модели SI, которая имеет логистика раствор, в котором каждый человек в конечном итоге заражается.
Модель SIR без витальной динамики

Динамика эпидемии, например, грипп, часто намного быстрее, чем динамика рождения и смерти, поэтому рождение и смерть часто опускаются в простых компартментных моделях. Система SIR без так называемой жизненной динамики (рождение и смерть, иногда называемая демографией), описанная выше, может быть выражена следующим набором обычных дифференциальные уравнения:[3][7]
куда численность уязвимого населения, количество зараженных, - количество удаленного населения (в результате смерти или выздоровления), и сумма этих трех.
Эта модель была впервые предложена Уильям Огилви Кермак и Андерсон Грей МакКендрик как частный случай того, что мы сейчас называем Теория Кермака – МакКендрика, и следил за работой Маккендрика с Рональд Росс.
Эта система нелинейный, однако можно вывести его аналитическое решение в неявной форме.[2] Во-первых, обратите внимание, что от:
следует, что:
выражая в математических терминах постоянство населения . Обратите внимание, что указанная выше взаимосвязь подразумевает, что нужно только изучить уравнение для двух из трех переменных.
Во-вторых, отметим, что динамика инфекционного класса зависит от следующего соотношения:
так называемой основной репродукционный номер (также называется базовым коэффициентом воспроизведения). Это соотношение рассчитывается как ожидаемое количество новых инфекций (эти новые инфекции иногда называют вторичными инфекциями) от одной инфекции в популяции, где все субъекты восприимчивы.[8][9] Эту идею, вероятно, можно будет легче понять, если мы скажем, что типичное время между контактами , а типичное время до удаления составляет . Отсюда следует, что в среднем количество контактов инфекционного индивида с другими перед был удален заразный:
Разделив первое дифференциальное уравнение на третье, разделение переменных и интегрируя, получаем
куда и - начальное количество соответственно восприимчивых и удаленных субъектов. Письмо для начальной доли восприимчивых людей, и и для доли восприимчивых и удаленных особей соответственно в пределе надо
(обратите внимание, что инфекционный отсек опустеет в этом пределе). трансцендентное уравнение есть решение с точки зрения Ламберт W функция,[10] а именно
Это показывает, что в конце эпидемии это соответствует простым предположениям модели SIR, если только , не все особи популяции были удалены, поэтому некоторые из них должны оставаться уязвимыми. Движущей силой, ведущей к прекращению эпидемии, является сокращение числа инфицированных. Эпидемия обычно не заканчивается из-за полного отсутствия уязвимых людей.
Роль как базовый номер репродукции и первоначальная восприимчивость чрезвычайно важны. Фактически, переписав уравнение для инфекционных индивидуумов следующим образом:
это дает, если:
тогда:
т.е. будет настоящая эпидемическая вспышка с увеличением числа инфекционных (которые могут достигнуть значительной части населения). Напротив, если
тогда
т.е. независимо от первоначального размера восприимчивой популяции болезнь никогда не может вызвать настоящую эпидемическую вспышку. Как следствие, ясно, что оба базовый номер репродукции и первоначальная восприимчивость чрезвычайно важны.
Сила заражения
Обратите внимание, что в приведенной выше модели функция:
моделирует скорость перехода из компартмента восприимчивых индивидов в компартмент инфекционных индивидов, так что он называется сила заражения. Однако для больших классов инфекционных заболеваний более реалистично рассматривать силу заражения, которая зависит не от абсолютного числа инфекционных субъектов, а от их доли (по отношению к общей постоянной популяции). ):
Капассо[11] а впоследствии другие авторы предложили нелинейные силы заражения для более реалистичного моделирования процесса заражения.
Точные аналитические решения модели SIR
В 2014 году Харко и соавторы получили точное так называемое аналитическое решение (включающее интеграл, который можно вычислить только численно) модели SIR.[2] В случае без настройки жизненной динамики, для и т.д., это соответствует следующей параметризации времени
за
с начальными условиями
куда удовлетворяет . По трансцендентному уравнению для выше следует, что , если и .
Эквивалентное так называемое аналитическое решение (включающее интеграл, который можно вычислить только численно), найденное Миллером[12][13] дает
Здесь можно интерпретировать как ожидаемое количество передач, полученных человеком за время . Два решения связаны соотношением .
Фактически тот же результат можно найти в оригинальной работе Кермака и МакКендрика.[1]
Эти решения можно легко понять, заметив, что все члены в правых частях исходных дифференциальных уравнений пропорциональны . Таким образом, уравнения можно разделить на , а время масштабируется таким образом, что дифференциальный оператор в левой части становится просто , куда , т.е. . Теперь все дифференциальные уравнения линейны, а третье уравнение имеет вид const., показывает, что и (и выше) просто линейно связаны.
Высокоточная аналитическая аппроксимация модели SIR была предоставлена Kröger и Schlickeiser,[4] так что нет необходимости выполнять численное интегрирование для решения модели SIR, для получения ее параметров из существующих данных или для прогнозирования будущей динамики эпидемии, моделируемой моделью SIR. Аппроксимант включает Ламберт W функция который является частью всего основного программного обеспечения для визуализации данных, такого как Майкрософт Эксель, MATLAB, и Mathematica.
Модель SIR с жизненной динамикой и постоянной численностью населения
Рассмотрим население, характеризующееся уровнем смертности и рождаемость , и где распространяется инфекционное заболевание.[3] Модель с силовой трансмиссией:
для которых равновесие без болезней (DFE) составляет:
В этом случае мы можем получить базовый номер репродукции:
который имеет пороговые свойства. Фактически, независимо от биологически значимых исходных значений, можно показать, что:
Точка EE называется эндемическим равновесием (болезнь не искоренена полностью и остается в популяции). Используя эвристические аргументы, можно показать, что может быть прочитано как среднее число инфекций, вызванных одним заразным субъектом в полностью восприимчивой популяции, указанная выше взаимосвязь биологически означает, что если это число меньше или равно единице, болезнь вымирает, тогда как если это число больше единицы болезнь останется постоянно эндемичной для населения.
Модель SIR


В 1927 году У. О. Кермак и А. Г. Маккендрик создали модель, в которой они рассматривали фиксированную популяцию только с тремя отделениями: восприимчивой и ; зараженный, ; и выздоровел, . В данной модели используются отсеки трех классов:[1]
- используется для представления людей, еще не инфицированных заболеванием в момент времени t, или людей, восприимчивых к заболеванию в популяции.
- обозначает людей из населения, которые были инфицированы этим заболеванием и способны распространить болезнь среди лиц, относящихся к уязвимой категории.
- это отделение, используемое для людей из популяции, которые были инфицированы, а затем удалены от болезни в результате иммунизации или в связи со смертью. Люди из этой категории не могут снова заразиться или передать инфекцию другим.
Ход этой модели можно рассматривать следующим образом:
Используя фиксированное население, в трех функциях решает, что значение должен оставаться постоянным в рамках моделирования, если моделирование используется для решения модели SIR. В качестве альтернативы аналитический аппроксимант[4] можно использовать без моделирования. Модель запускается со значениями , и . Это количество людей в уязвимых, зараженных и удаленных категориях в момент времени, равное нулю. Если предполагается, что модель SIR выполняется все время, эти начальные условия не являются независимыми.[4] Впоследствии потоковая модель обновляет три переменные для каждой временной точки с заданными значениями для и . Моделирование сначала обновляет инфицированных от уязвимых, а затем удаленная категория обновляется из зараженной категории для следующего момента времени (t = 1). Это описывает поток людей между тремя категориями. Во время эпидемии эта модель не меняет категорию восприимчивых, меняется с течением эпидемии, как и . Эти переменные определяют продолжительность эпидемии и должны обновляться с каждым циклом.
При формулировании этих уравнений было сделано несколько предположений: во-первых, человек в популяции должен рассматриваться как имеющий такую же вероятность, как и любой другой человек, заразиться этим заболеванием со скоростью и равная доля людей, с которыми человек контактирует в единицу времени. Тогда пусть быть умножением и . Это вероятность передачи, умноженная на частоту контакта. Кроме того, инфицированный человек вступает в контакт с человек в единицу времени, тогда как только часть, из них восприимчивы. Таким образом, у нас каждый инфекционный может заразить восприимчивых людей, и, следовательно, общее количество восприимчивых, инфицированных инфекционными болезнями, в единицу времени равно . Применительно ко второму и третьему уравнениям считайте, что популяция, покидающая уязвимый класс, равна числу, попавшему в инфицированный класс. Однако число, равное дроби (что представляет собой средний показатель выздоровления / смертности, или средний период заражения) инфекционные болезни покидают этот класс в единицу времени, чтобы войти в удаленный класс. Эти процессы, которые происходят одновременно, называются Законом массового действия, широко распространенной идеей о том, что скорость контакта между двумя группами в популяции пропорциональна размеру каждой из заинтересованных групп. Наконец, предполагается, что скорость инфицирования и выздоровления намного выше, чем временной масштаб рождений и смертей, и поэтому в этой модели эти факторы не учитываются.[14]
Устойчивые решения
Ожидаемая продолжительность восприимчивости будет куда отражает время жизни (продолжительность жизни) и отражает время нахождения в восприимчивом состоянии до заражения, что можно упростить[15] к:
таким образом, чтобы число восприимчивых людей было числом, попавшим в чувствительный отсек кратная продолжительность восприимчивости:
Аналогично, постоянное количество инфицированных людей - это количество, перешедшее в инфицированное состояние из восприимчивого состояния (число восприимчивых, умноженное на скорость инфицирования раз превышает продолжительность заразности :
Прочие модели-купе
Существует множество модификаций модели SIR, в том числе те, которые включают рождение и смерть, где после выздоровления нет иммунитета (модель SIS), где иммунитет длится только в течение короткого периода времени (SIRS), где есть латентный период болезнь, при которой человек не заразен (SEIS и SEIR ), и где младенцы могут родиться с иммунитетом (MSIR).
Варианты базовой модели SIR
Модель SIS
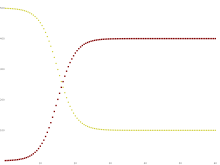
Некоторые инфекции, например, из простуда и грипп, не дают длительного иммунитета. Такие инфекции не дают иммунитета после выздоровления от инфекции, и люди снова становятся восприимчивыми.

У нас есть модель:
Обратите внимание, что, обозначая N всего населения он считает, что:
- .
Следует, что:
- ,
т.е. динамикой инфекционных управляет логистическая функция, так что :
Можно найти аналитическое решение этой модели (сделав преобразование переменных: и подставив это в уравнения среднего поля),[16] таким образом, что базовый коэффициент воспроизводства больше единицы. Решение дается как
- .
куда это эндемичная инфекционная популяция, , и . Поскольку предполагается, что система закрыта, тогда уязвимая популяция .
Как частный случай, обычную логистическую функцию получают, предполагая . Это также можно учесть в модели SIR с , т.е. удаление не произойдет. Это SI модель.[17] Система дифференциальных уравнений с использованием таким образом сводится к:
В долгосрочной перспективе в модели SI все люди будут инфицированы. Для оценки эпидемического порога в модели SIS в сетях см. Parshani et al.[18]
Модель SIRD


В Модель восприимчивого инфицированного выздоровевшего умершего различает Восстановлен (имеется в виду, в частности, люди, пережившие болезнь и получившие иммунитет) и Покойный.[нужна цитата ] В этой модели используется следующая система дифференциальных уравнений:
куда - уровни инфицирования, выздоровления и смертности соответственно.[19]
Модель MSIR
При многих инфекциях, в том числе корь, младенцы не рождаются в чувствительном отделении, но обладают иммунитетом к болезни в течение первых нескольких месяцев жизни благодаря защите от материнских антител (передаваемых через плацента и дополнительно через молозиво ). Это называется пассивный иммунитет. Эту дополнительную деталь можно показать, включив класс M (для материнского иммунитета) в начало модели.

Чтобы обозначить это математически, добавлен дополнительный отсек, M(т). Это приводит к следующим дифференциальным уравнениям:
Состояние перевозчика
Некоторые люди, перенесшие инфекционное заболевание, например туберкулез никогда полностью не выздоравливай и продолжай нести инфекции, при этом сами не страдая заболеванием. Затем они могут вернуться в инфекционный отсек и страдать от симптомов (как при туберкулезе) или они могут продолжать инфицировать других в состоянии своего носительства, не испытывая при этом симптомов. Самый известный пример этого, наверное, Мэри Мэллон, которые заразили 22 человека брюшной тиф. Отсек для переноски обозначен буквой C.

Модель SEIR
Для многих важных инфекций существует значительный инкубационный период, в течение которого люди были инфицированы, но сами еще не заразны. В этот период человек находится в купе. E (для выставленных).

Предполагая, что инкубационный период является случайной величиной с экспоненциальным распределением с параметром (т.е. средний инкубационный период составляет ), а также при наличии жизненной динамики с рождаемостью равняется смертности , у нас есть модель:
У нас есть но это постоянно только из-за упрощающего предположения, что уровни рождаемости и смертности равны; в целом это переменная.
Для этой модели базовый номер репродукции:
Подобно модели SIR, также и в этом случае мы имеем равновесие без болезней (N, 0,0,0) и эндемического равновесия EE, и можно показать, что независимо от биологически значимых начальных условий
он утверждает, что:
В случае периодически меняющейся скорости контакта условием глобальной привлекательности DFE является наличие следующей линейной системы с периодическими коэффициентами:
устойчиво (т.е. имеет собственные значения Флоке внутри единичной окружности на комплексной плоскости).
Модель SEIS
Модель SEIS похожа на модель SEIR (см. Выше) за исключением того, что в конце концов иммунитет не приобретается.
В этой модели инфекция не оставляет иммунитета, поэтому выздоровевшие люди снова становятся восприимчивыми, возвращаясь в S(т) отсек. Следующие дифференциальные уравнения описывают эту модель:
Модель MSEIR
Для случая заболевания с факторами пассивного иммунитета и латентным периодом существует модель MSEIR.
Модель MSEIRS
Модель MSEIRS похожа на MSEIR, но иммунитет в классе R будет временным, так что люди будут восстанавливать свою восприимчивость, когда временный иммунитет закончится.
Переменная частота контактов
Как известно, вероятность заболеть не постоянна во времени. По мере развития пандемии реакции на пандемию могут изменить частоту контактов, которая в более простых моделях считается постоянной. Контрмеры, такие как маски, социальное дистанцирование и изоляция, изменят частоту контактов таким образом, чтобы снизить скорость пандемии.
Кроме того, некоторые заболевания носят сезонный характер, например, вирусы простуды, которые более распространены зимой. С детскими болезнями, такими как корь, эпидемический паротит и краснуха, существует сильная корреляция со школьным календарем, так что во время школьных каникул вероятность заболеть такой болезнью резко снижается. Как следствие, для многих классов заболеваний следует учитывать силу инфекции с периодически («сезонной») изменяющейся частотой контактов.
с периодом T равным одному году.
Таким образом, наша модель становится
(динамика восстановленных легко следует из ), т.е. нелинейная система дифференциальных уравнений с периодически меняющимися параметрами. Хорошо известно, что в этом классе динамических систем могут происходить очень интересные и сложные явления нелинейного параметрического резонанса. Легко увидеть, что если:
тогда как если интеграл больше единицы, болезнь не исчезнет, и могут быть такие резонансы. Например, рассматривая периодически изменяющуюся частоту контакта как `` вход '' системы, мы получаем, что выход представляет собой периодическую функцию, период которой кратен периоду входа. Это позволило внести вклад в объяснение многолетнего (обычно раз в два года) эпидемические вспышки некоторых инфекционных заболеваний как взаимосвязь между периодом колебаний частоты контакта и псевдопериодом затухающих колебаний вблизи эндемического равновесия. Примечательно, что в некоторых случаях поведение также может быть квазипериодическим или даже хаотическим.
Пандемия
Модель для оценки вероятности глобального распространения и объявления пандемии была недавно разработана Valdez et al. [20]
Моделирование вакцинации
Модель SIR может быть изменена для моделирования вакцинации.[21] Обычно они вводят дополнительный отсек в модель SIR, , для вакцинированных лиц. Ниже приведены некоторые примеры.
Вакцинация новорожденных
При наличии инфекционного заболевания одной из основных задач является его искоренение с помощью профилактических мер и, если возможно, путем создания программы массовой вакцинации. Рассмотрим болезнь, от которой новорожденных вакцинируют (вакциной, дающей пожизненный иммунитет) со скоростью :
куда - это класс вакцинированных субъектов. Немедленно показать, что:
таким образом, мы будем иметь дело с долгосрочным поведением и , для чего:
Другими словами, если
Программа вакцинации не увенчалась успехом в искоренении болезни, напротив, она останется эндемичной, хотя и на более низком уровне, чем в случае отсутствия вакцинации. Это означает, что математическая модель предполагает, что для болезни, базовый номер репродукции может достигать 18 лет, необходимо вакцинировать не менее 94,4% новорожденных, чтобы искоренить болезнь.
Вакцинация и информация
Современное общество сталкивается с проблемой «рационального» исключения, т. Е. Решения семьи не вакцинировать детей в результате «рационального» сравнения между предполагаемым риском заражения и риском нанесения ущерба от вакцины. Чтобы оценить, действительно ли такое поведение рационально, то есть может ли оно в равной степени привести к искоренению болезни, можно просто предположить, что частота вакцинации является возрастающей функцией количества инфекционных субъектов:
В таком случае условием искоренения становится:
то есть базовый уровень вакцинации должен быть выше порога «обязательной вакцинации», который в случае исключения не может выполняться. Таким образом, «рациональное» исключение может быть близоруким, поскольку оно основано только на нынешнем низком уровне заболеваемости из-за высокого охвата вакцинацией, а не на учете будущего возобновления инфекции из-за снижения охвата.
Вакцинация не новорожденных
В случае вакцинации не новорожденных со скоростью ρ уравнение для восприимчивого и вакцинированного субъекта должно быть изменено следующим образом:
приводит к следующему условию искоренения:
Стратегия импульсной вакцинации
Эта стратегия позволяет многократно вакцинировать определенную возрастную группу (например, детей раннего возраста или пожилых людей) из уязвимого населения с течением времени. Используя эту стратегию, затем сразу же удаляется блок восприимчивых людей, что позволяет ликвидировать инфекционное заболевание (например, корь) у всего населения. Каждые T единиц времени вакцинируют постоянную долю p восприимчивых субъектов за относительно короткое (относительно динамики болезни) время. Это приводит к следующим импульсным дифференциальным уравнениям для восприимчивых и вакцинированных субъектов:
Это легко увидеть, установив я = 0 получается, что динамика восприимчивых субъектов определяется:
и что условие искоренения:
Влияние возраста: возрастные модели
Возраст оказывает сильное влияние на скорость распространения болезни среди населения, особенно на частоту контактов. Этот показатель суммирует эффективность контактов между восприимчивыми и инфекционными субъектами. С учетом возраста эпидемических классов (чтобы ограничиться схемой «восприимчивые - инфекционные - удаленные»), такая, что:
(куда - максимально допустимый возраст), и их динамика описывается не "простыми" уравнениями в частных производных, как можно было бы подумать, а интегро-дифференциальные уравнения:
куда:
сила заражения, которая, конечно же, будет зависеть, хоть ядро контакта о взаимодействиях между возрастами.
Сложность добавляют начальные условия для новорожденных (т.е. при a = 0), которые просты для инфекционных и устраняются:
но это нелокально для плотности восприимчивых новорожденных:
куда это плодородие взрослых.
Более того, определяя теперь плотность всего населения получается:
В простейшем случае равной рождаемости в трех эпидемических классах мы имеем, что для достижения демографического равновесия необходимо следующее необходимое и достаточное условие, связывающее рождаемость: со смертностью должен содержать:
и демографическое равновесие
автоматическое обеспечение существования безболезненного решения:
Базовое число воспроизведения можно вычислить как спектральный радиус соответствующего функционального оператора.
Другие соображения в рамках компартментальных моделей эпидемии
Вертикальная передача
В случае некоторых заболеваний, таких как СПИД и гепатит B, потомство инфицированных родителей может родиться инфицированным. Эта передача болезни от матери называется вертикальной передачей. Приток дополнительных членов в инфицированную категорию можно учесть в рамках модели, включив часть новорожденных членов в инфицированный компартмент.[22]
Векторная передача
Болезни, передающиеся от человека человеку косвенно, например, малярия, передающаяся через комаров, передаются через переносчиков. В этих случаях инфекция передается от человека к насекомому, и модель эпидемии должна включать оба вида, что обычно требует гораздо большего количества компартментов, чем модель прямой передачи.[22][23]
Другие
Другие случаи, которые, возможно, необходимо учитывать при моделировании эпидемии, включают такие вещи, как следующее:[22]
- Неоднородное перемешивание
- Переменная заразительность
- Распределения, которые пространственно неоднородны
- Заболевания, вызванные макропаразитами
Детерминированные модели эпидемии в сравнении со стохастическими
Важно подчеркнуть, что представленные здесь детерминированные модели действительны только в случае достаточно больших популяций, и поэтому их следует использовать с осторожностью.[24]
Если быть более точным, эти модели действительны только в термодинамический предел, где население фактически бесконечно. В стохастических моделях долгосрочное эндемическое равновесие, полученное выше, не выполняется, поскольку существует конечная вероятность того, что количество инфицированных людей в системе упадет ниже одного. В настоящей системе патоген может не размножаться, поскольку ни один хозяин не будет инфицирован. Но в детерминированных моделях среднего поля количество зараженных может принимать реальные, а именно нецелые значения зараженных хостов, а количество хостов в модели может быть меньше единицы, но больше нуля, что позволяет патоген в модели для размножения. Надежность разделенных моделей ограничивается разделенными приложениями.
Одно из возможных расширений моделей среднего поля рассматривает распространение эпидемий в сети на основе концепций теории перколяции.[25] Стохастические модели эпидемий изучались в разных сетях.[26][27][28] и совсем недавно применительно к COVID-19 пандемия.[29]
Смотрите также
- Математическое моделирование в эпидемиологии
- Задача изменяемой площади
- Матрица следующего поколения
- Оценка рисков
- Скорость атаки
Рекомендации
- ^ а б c Kermack, W. O .; Маккендрик, А.Г. (1927). «Вклад в математическую теорию эпидемий». Труды Королевского общества А. 115 (772): 700–721. Bibcode:1927RSPSA.115..700K. Дои:10.1098 / rspa.1927.0118.
- ^ а б c Харко, Тибериу; Lobo, Francisco S.N .; Мак, М. К. (2014). «Точные аналитические решения модели эпидемии« восприимчивые-инфицированные-выздоровевшие »(SIR) и модели SIR с равными показателями смертности и рождаемости». Прикладная математика и вычисления. 236: 184–194. arXiv:1403.2160. Bibcode:2014arXiv1403.2160H. Дои:10.1016 / j.amc.2014.03.030. S2CID 14509477.
- ^ а б c Бекли, Росс; Weatherspoon, Cametria; Александр, Михаил; Чендлер, Марисса; Джонсон, Энтони; Батт, Ган С. (2013). «Моделирование эпидемий с помощью дифференциальных уравнений» (PDF). Внутренний отчет государственного университета Теннесси. Получено 19 июля, 2020.
- ^ а б c d Крегер, Мартин; Шликкейзер, Рейнхард (2020). «Аналитическое решение SIR-модели для временной эволюции эпидемий. Часть A: Не зависящий от времени фактор воспроизводства». Журнал физики А. Дои:10.1088 / 1751-8121 / abc65d. S2CID 225555567.
- ^ а б Ян, Уюэ; Чжан, Дунъянь; Пэн, Лянжун; Чжугэ, Чанцзин; Лю, Лю (2020). «Рациональная оценка различных моделей эпидемии на основе данных Китая о COVID-19». arXiv:2003.05666v1 [q-bio.PE ].
- ^ Крылова, О .; Зарабатывай, диджей (15 мая 2013 г.). «Влияние распределения инфекционных периодов на прогнозируемые переходы в динамике детских болезней». Интерфейс J R Soc. 10 (84). Дои:10.1098 / rsif.2013.0098. ЧВК 3673147. PMID 23676892.
- ^ Hethcote H (2000). «Математика инфекционных болезней». SIAM Обзор. 42 (4): 599–653. Bibcode:2000SIAMR..42..599H. Дои:10.1137 / s0036144500371907.
- ^ Бейли, Норман Т. Дж. (1975). Математическая теория инфекционных болезней и ее приложения (2-е изд.). Лондон: Гриффин. ISBN 0-85264-231-8.
- ^ Соня Алтизер; Нанн, Чарльз (2006). Инфекционные болезни приматов: поведение, экология и эволюция. Оксфордская серия по экологии и эволюции. Оксфорд [Оксфордшир]: Издательство Оксфордского университета. ISBN 0-19-856585-2.
- ^ Wolfram Research, Inc. "Mathematica, Версия 12.1". Шампейн Иллинойс, 2020.
- ^ Капассо, В. (1993). Математическая структура эпидемических систем. Берлин: Springer. ISBN 3-540-56526-4.
- ^ Миллер, Дж. К. (2012). «Заметка о выводе окончательных размеров эпидемии». Вестник математической биологии. 74 (9). раздел 4.1. Дои:10.1007 / s11538-012-9749-6. ЧВК 3506030. PMID 22829179.
- ^ Миллер, Дж. К. (2017). «Математические модели распространения болезни SIR с комбинированными путями передачи несексуальным и половым путем». Моделирование инфекционных заболеваний. 2 (1). раздел 2.1.3. Дои:10.1016 / j.idm.2016.12.003. ЧВК 5963332. PMID 29928728.
- ^ Padua RN, Tulang AB (2 декабря 2010 г.). «Эпидемиологическая модель, зависящая от плотности распространения инфекционных заболеваний». Лисео Журнал исследований в области высшего образования. 6 (2). Дои:10.7828 / ljher.v6i2.62.
- ^ Мэй, Роберт М.; Андерсон, Б. (1992-09-24). Инфекционные болезни человека: динамика и контроль (Пересмотренная ред.). Оксфорд: Издательство Оксфордского университета. ISBN 9780198540403.
- ^ Хеткот, Герберт В. (1989). «Три основные эпидемиологические модели». В Levin, Simon A .; Hallam, Thomas G .; Гросс, Луи Дж. (Ред.). Прикладная математическая экология. Биоматематика. 18. Берлин: Springer. С. 119–144. Дои:10.1007/978-3-642-61317-3_5. ISBN 3-540-19465-7.
- ^ (стр.19) Модель SI
- ^ Р. Паршани, С. Карми, С. Хавлин (2010). «Эпидемический порог для модели восприимчивости-инфекционно-восприимчивости в случайных сетях». Phys. Rev. Lett. 104 (25): 258701 (2010). arXiv:0909.3811. Bibcode:2010PhRvL.104y8701P. Дои:10.1103 / PhysRevLett.104.258701. PMID 20867419.CS1 maint: несколько имен: список авторов (связь)
- ^ Первое и второе дифференциальные уравнения преобразуются и приводятся к тому же виду, что и для Модель SIR над.
- ^ Л. Д. Вальдес, Л. А. Браунштейн, С. Хавлин (2020). «Распространение эпидемии по модульным сетям: страх объявить пандемию». Физический обзор E. 101 (3): 032309. arXiv:1909.09695. Bibcode:2020PhRvE.101c2309V. Дои:10.1103 / PhysRevE.101.032309. PMID 32289896. S2CID 202719412.CS1 maint: несколько имен: список авторов (связь)
- ^ Гао, Шуцзин; Тэн, Чжидун; Nieto, Juan J .; Торрес, Анджела (2007). «Анализ модели эпидемии SIR с импульсной вакцинацией и распределенной временной задержкой». Журнал биомедицины и биотехнологии. 2007: 64870. Дои:10.1155/2007/64870. ЧВК 2217597. PMID 18322563.
- ^ а б c Брауэр, Ф .; Кастильо-Чавес, К. (2001). Математические модели в популяционной биологии и эпидемиологии. Нью-Йорк: Спрингер. ISBN 0-387-98902-1.
- ^ Для получения дополнительной информации об этом типе модели см. Андерсон, Р.М., изд. (1982). Популяционная динамика инфекционных заболеваний: теория и приложения. Лондон-Нью-Йорк: Чепмен и Холл. ISBN 0-412-21610-8.
- ^ Бартлетт MS (1957). «Периодичность кори и размер сообщества». Журнал Королевского статистического общества, серия A. 120 (1): 48–70. Дои:10.2307/2342553. JSTOR 2342553. S2CID 91114210.
- ^ Крокколо Ф. и Роман Х. Э. (2020). «Распространение инфекций на случайных графах: модель перколяционного типа для COVID-19». Хаос, солитоны и фракталы. 139: 110077. arXiv:2006.10490. Дои:10.1016 / j.chaos.2020.110077. ЧВК 7332959. PMID 32834619. S2CID 219792089.
- ^ Мэй, Роберт М .; Ллойд, Алан Л. (2001-11-19). «Динамика заражения в безмасштабных сетях». Физический обзор E. 64 (6): 066112. Bibcode:2001PhRvE..64f6112M. Дои:10.1103 / PhysRevE.64.066112. PMID 11736241.
- ^ Пастор-Саторрас, Ромуальдо; Веспиньяни, Алессандро (2001-04-02). «Распространение эпидемии в безмасштабных сетях». Письма с физическими проверками. 86 (14): 3200–3203. arXiv:cond-mat / 0010317. Bibcode:2001ПхРвЛ..86.3200П. Дои:10.1103 / PhysRevLett.86.3200. HDL:2117/126209. PMID 11290142. S2CID 16298768.
- ^ Ньюман, М. Э. Дж. (26 июля 2002 г.). «Распространение эпидемической болезни в сети». Физический обзор E. 66 (1): 016128. arXiv:cond-mat / 0205009. Bibcode:2002PhRvE..66a6128N. Дои:10.1103 / PhysRevE.66.016128. PMID 12241447. S2CID 15291065.
- ^ Вонг, Феликс; Коллинз, Джеймс Дж. (02.11.2020). «Доказательства того, что сверхраспространение коронавируса носит толстый хвост». Труды Национальной академии наук. 117 (47): 29416–29418. Дои:10.1073 / pnas.2018490117. ISSN 0027-8424. PMID 33139561. S2CID 226242440.
дальнейшее чтение
- Мэй, Роберт М.; Андерсон, Рой М. (1991). Инфекционные болезни человека: динамика и контроль. Оксфорд: Издательство Оксфордского университета. ISBN 0-19-854040-X.
- Винницкий, Э .; Уайт, Р. Г., ред. (2010). Введение в моделирование инфекционных заболеваний. Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-856576-5.
внешняя ссылка
- Модель SIR: онлайн-эксперименты с JSXGraph
- «Имитация эпидемии». 3Синий 1Коричневый. 27 марта 2020 г. - через YouTube.

![{ displaystyle { begin {align} & { frac {dS} {dt}} = - { frac { beta IS} {N}}, [6pt] и { frac {dI} {dt} } = { frac { beta IS} {N}} - gamma I, [6pt] & { frac {dR} {dt}} = gamma I, end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29728a7d4bebe8197dca7d873d81b9dce954522e)







































![{ Displaystyle { begin {align} S (t) & = S (0) e ^ {- xi (t)} [8pt] I (t) & = NS (t) -R (t) [8pt] R (t) & = R (0) + rho xi (t) [8pt] xi (t) & = { frac { beta} {N}} int _ {0 } ^ {t} I (t ^ {*}) , dt ^ {*} конец {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f6ac0eda5b1278f31690939cdfa1f4daa6b1762)











![{ displaystyle { begin {align} { frac {dS} {dt}} & = Lambda - mu S - { frac { beta IS} {N}} [8pt] { frac {dI } {dt}} & = { frac { beta IS} {N}} - gamma I- mu I [8pt] { frac {dR} {dt}} & = gamma I- mu R end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0dad81f67db0f075bec720950feaeeb653916028)





























![{ displaystyle operatorname {E} [ min (T_ {L} mid T_ {S})]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4a1be62e9d674a94ab536644fa3f56c77503cdf)


![{ displaystyle operatorname {E} [ min (T_ {L} mid T_ {S})] = int _ {0} ^ { infty} e ^ {- ( mu + delta) x} , dx = { frac {1} { mu + delta}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cd0d8220231a82d54da2c2e818ee2b426c23e62)





![{ displaystyle { begin {align} { frac {dS} {dt}} & = - { frac { beta SI} {N}} + gamma I [6pt] { frac {dI} { dt}} & = { frac { beta SI} {N}} - gamma I end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/605895c64d824511c45ba20ba151ce5b1cec12fc)



![{ Displaystyle { begin {align} & { frac { beta} { gamma}} leq 1 Rightarrow lim _ {t to + infty} I (t) = 0, [6pt] & { frac { beta} { gamma}}> 1 Rightarrow lim _ {t to + infty} I (t) = left (1 - { frac { gamma} { beta}} right) N. end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05a8022e25ade4141cdf7a411b25dbb8abfc66b9)
















![{ displaystyle { begin {align} & { frac {dS} {dt}} = - { frac { beta IS} {N}}, [6pt] и { frac {dI} {dt} } = { frac { beta IS} {N}} - gamma I- mu I, [6pt] & { frac {dR} {dt}} = gamma I, [6pt] & { frac {dD} {dt}} = mu I, end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1211c5146940bacb8a0df97780330a2599eb4625)

![{ displaystyle { begin {align} { frac {dM} {dT}} & = Lambda - delta M- mu M [8pt] { frac {dS} {dT}} & = delta M - { frac { beta SI} {N}} - mu S [8pt] { frac {dI} {dT}} & = { frac { beta SI} {N}} - gamma I- mu I [8pt] { frac {dR} {dT}} & = gamma I- mu R end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07401153970a3f9f70f53e3c6ccd16bfe72c87e8)

![{ displaystyle { begin {align} { frac {dS} {dt}} & = Lambda N- mu S - { frac { beta IS} {N}} [8pt] { frac { dE} {dt}} & = { frac { beta IS} {N}} - ( mu + a) E [8pt] { frac {dI} {dt}} & = aE - ( gamma + mu) I [8pt] { frac {dR} {dt}} & = gamma I- mu R. end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/feeb0e885c70ec83c36cec8b33f5ea696f3761a6)


![left (S (0), E (0), I (0), R (0) right) in left {(S, E, I, R) in [0, N] ^ {4 }: S geq 0, E geq 0, I geq 0, R geq 0, S + E + I + R = N right }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3190cc59889dab0e9167d4241c117e8a2cefe0e0)



![{ displaystyle { begin {align} { frac {dE_ {1}} {dt}} & = beta (t) I_ {1} - ( gamma + a) E_ {1} [8pt] { frac {dI_ {1}} {dt}} & = aE_ {1} - ( gamma + mu) I_ {1} end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4e137f34047a193685ff0b616c6f86e702f677b)

![{ displaystyle { begin {align} { frac {dS} {dT}} & = Lambda - { frac { beta SI} {N}} - mu S + gamma I [6pt] { frac {dE} {dT}} & = { frac { beta SI} {N}} - ( epsilon + mu) E [6pt] { frac {dI} {dT}} & = varepsilon E - ( gamma + mu) I end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c400c2e342e82c152cacef3141dc8e5840826218)

![{ displaystyle { begin {align} { frac {dM} {dT}} & = Lambda - delta M- mu M [6pt] { frac {dS} {dT}} & = delta M - { frac { beta SI} {N}} - mu S [6pt] { frac {dE} {dT}} & = { frac { beta SI} {N}} - ( varepsilon + mu) E [6pt] { frac {dI} {dT}} & = varepsilon E - ( gamma + mu) I [6pt] { frac {dR} {dT}} & = gamma I- mu R end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bf59ff982500a2b882e26d1635ecf9efb74110e)


![{ displaystyle { begin {align} { frac {dS} {dt}} & = mu N- mu S- beta (t) { frac {I} {N}} S [8pt] { frac {dI} {dt}} & = beta (t) { frac {I} {N}} S - ( gamma + mu) I end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fc5024950a3e4b440788219d6c97f29cab91895)




![{ displaystyle { begin {align} { frac {dS} {dt}} & = nu N (1-P) - mu S- beta { frac {I} {N}} S [ 8pt] { frac {dI} {dt}} & = beta { frac {I} {N}} S - ( mu + gamma) I [8pt] { frac {dV} {dt} } & = nu NP- mu V end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63771aa3a5908cf37d4614cbdc9d655f2d734f10)






![{ displaystyle { begin {align} { frac {dS} {dt}} & = mu N (1-P) - mu S- rho S- beta { frac {I} {N}} S [8pt] { frac {dV} {dt}} & = mu NP + rho S- mu V end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b556735b37a851da6eeffe357d39ef0e64a20187)

![{ displaystyle { begin {align} { frac {dS} {dt}} & = mu N- mu S- beta { frac {I} {N}} S, quad S (nT ^ { +}) = (1-p) S (nT ^ {-}), && n = 0,1,2, ldots [8pt] { frac {dV} {dt}} & = - mu V, quad V (nT ^ {+}) = V (nT ^ {-}) + pS (nT ^ {-}), && n = 0,1,2, ldots end {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa20fd9c5facbd652241be938c9ac9fb3dae0204)





















